Découverte d’un chef d’orchestre de l’agressivité des tumeurs cérébrales les plus malignes
La grande diversité des cellules malignes des tumeurs cérébrales est une source majeure de résistance aux traitements. Cette diversité est le fruit de mutations génétiques et plus encore d’adaptations fonctionnelles des cellules aux variations de leur environnement. En comparant les gènes dont les marques épigénétiques varient avec l’état fonctionnel des cellules, une équipe du laboratoire Neurosciences Paris-Seine, en collaboration avec des chercheurs de l’Institut de Biologie Valrose, de l’hôpital Pasteur de Nice, et de l’Institut universitaire d'hématologie, révèle que l’agressivité des cellules dépend du facteur de transcription ARNT2. Ces travaux ont été publiés le 17 novembre 2017 dans la revue Acta Neuropathologica.
Une des sources importantes de la résistance des tumeurs cancéreuses solides aux traitements actuels est l’hétérogénéité des cellules au sein de la tumeur. Le glioblastome, la plus fréquente et la plus grave des tumeurs du cerveau chez l’adulte, est un exemple caricatural de cette hétérogénéité. La diversité des cellules tumorales qui le composent provient non seulement de l’accumulation de mutations mais aussi de la capacité des cellules à changer leur mode de fonctionnement dans un contexte génomique constant. On retrouve ainsi des cellules prolifératives ou quiescentes, plus ou moins motiles, sensibles ou résistantes aux thérapies, voire même tumorigènes ou non, c’est-à-dire capables ou non d’initier à elles seules une nouvelle tumeur. Cette plasticité fonctionnelle remarquable permet l’adaptation des cellules des glioblastomes aux modifications de leur environnement au cours de la croissance de la tumeur mais participe également à la résistance aux traitements actuels. En élucider les mécanismes est donc essentiel pour développer des thérapies plus efficaces.
Pour identifier les réseaux moléculaires qui distinguent les sous-populations cellulaires les plus agressives - celles aux propriétés tumorigènes – les chercheurs ont exploité les changements de marques épigénétiques qui accompagnent les changements d'état fonctionnel des cellules. Deux marques de l’histone 3, la triméthylation de la lysine 4 (H3K4me3) associée à l’expression active des gènes et celle de la lysine 27 (H3K27me3) associée à une répression de l’expression d’un gène, ont été examinées. Ils sont partis de cellules de glioblastome dont les propriétés initiatrices de tumeur sont bloquées par l’expression forcée d’un groupe de micro-ARN. Chez les patients, ce groupe de micro-ARN est associé aux régions de la tumeur présentant une faible prolifération et un aspect différencié. Ils ont combiné immunoprécipitations de la chromatine et séquençage de l’ADN qui y est associé, manipulations génétiques de cellules cancéreuses isolées à partir de résections chirurgicales de différentes patients atteints de glioblastome, greffes intracérébrales chez la souris et analyses histologiques des tumeurs des patients.
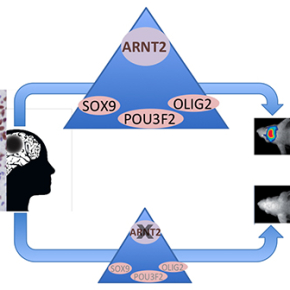
L’identification des gènes associés à un changement de marques d’histone a permis de révéler un réseau de facteurs de transcription liés au comportement cancéreux, à l'état souche et au développement neuronal, ainsi qu’une association insoupçonnée entre la répression du facteur de transcription ARNT2 et la perte de tumorigénicité cellulaire. Chez les patients, l’expression d’ARNT2 prédomine dans les zones prolifératives de la tumeur. Inversement l’inhibition de l’expression d’ARNT2 supprime la capacité des cellules à former une tumeur quand elles sont greffées in vivo. ARNT2 est donc nécessaire à la tumorigénicité des cellules, notamment en contrôlant l’expression de trois facteurs de transcription pro-tumorigènes, SOX9, POU3F2 et OLIG2. ARNT2 se révèle donc être un composant essentiel du réseau de facteurs de transcription responsable de l'agressivité des cellules de glioblastome.
Ces résultats fournissent la première démonstration d'un rôle fonctionnel d'ARNT2 dans les cancers du cerveau et apportent une vision nouvelle et inattendue du réseau et de l'organisation hiérarchique du réseau de facteurs de transcription qui régit la tumorigénicité des cellules de glioblastome.
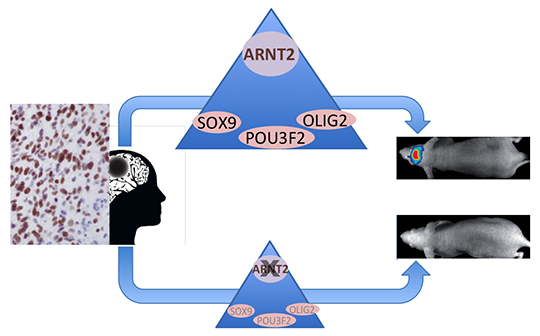
©.Alexandra Bogeas, Elias El-Habr et Ghislaine Morvan-Dubois
En savoir plus
-
Changes in chromatin state reveal ARNT2 at a node of a tumorigenic transcription factor signature driving glioblastoma cell aggressiveness.
Bogeas A, Morvan-Dubois G, El-Habr EA, Lejeune FX, Defrance M, Narayanan A, Kuranda K, Burel-Vandenbos F, Sayd S, Delaunay V, Dubois LG, Parrinello H, Rialle S, Fabrega S, Idbaih A, Haiech J, Bièche I, Virolle T, Goodhardt M, Chneiweiss H, Junier MP.
Acta Neuropathol. 2017 Nov 17. doi: 10.1007/s00401-017-1783-x.