Déacétylation et remodelage de la chromatine, un même combat anti-transposons.
L'enroulement des ADN d'eucaryotes autour des histones, sous forme de fibres chromatiniennes, peut réduire leurs gènes au silence transcriptionnel. Cette étude, publiée dans la revue Nature Communications, montre que les ovaires de drosophile sont capables de se défendre contre les transposons qui les parasitent, en inhibant leur transcription grâce à une déacétylase d'histones, Rpd3, et à une protéine "enrouleuse de chromatine", Mi-2.
Le développement harmonieux des organismes pluricellulaires implique une régulation fine et coordonnée de la transcription en ARN messagers de groupes de gènes impliqués dans divers processus de différenciation cellulaire. Une part importante de ces régulations consiste en une répression transcriptionnelle associée à des modifications de la chromatine des gènes correspondants. Les effecteurs chromatiniens responsables de ces modifications, appelés co-répresseurs, sont guidés vers les gènes à réprimer par des facteurs de transcription capables de se lier à des séquences d'ADN localisées dans les régions régulatrices des gènes. Chez la drosophile, par exemple, le co-répresseur dMec, composé de la protéine MEP-1 associée au remodeleur chromatinien Mi-2, est guidé vers ses gènes cibles grâce à son interaction avec le facteur de transcription Sp3. Il en résulte une répression de ces gènes qui est probablement due au remodelage de leur chromatine par Mi-2.
Les gènes ne constituent qu'une toute petite partie du génome de ces organismes, une partie importante étant occupée par des "parasites génétiques", appelés transposons. Même s'ils sont le plus souvent inactifs, ils sont cependant capables de multiplier leur séquence d'ADN par transposition réplicative au sein des génomes, entrainant de possibles accidents génétiques. Il est donc capital de pouvoir empêcher l'expression, et donc la transposition de ces parasites, dans les cellules germinales responsables de la transmission du génome aux générations ultérieures.
La répression des transposons semble souvent assurée grâce à des mécanismes assez semblables à ceux de la répression génique, bien qu’avec quelques différences majeures. L'une de ces différences concerne le mécanisme de ciblage des séquences chromatiniennes à réprimer. L'équivalent du facteur de transcription est une protéine "Argonaute" guidée vers sa cible par un petit ARN non-codant qui s'hybride non pas avec l'ADN du transposon, mais avec son ARN pré-messager. Le caractère très transitoire de ce ciblage explique la difficulté de caractériser biochimiquement le complexe co-répresseur associé à la protéine Argonaute.
Dans les cellules germinales des femelles de drosophile, le guidage d'une protéine Argonaute (Piwi) vers l'ARN pré-messager d'un transposon, grâce à son piARN (piwi-ARN) y apporte le co-répresseur SETDB1, une histone lysine methyltransférase. Dans cette étude, les chercheurs ont découvert trois autres interacteurs de Piwi, dont, justement, les deux protéines Mi-2 et MEP-1 du complexe dMec précédemment impliqué dans la répression génique médiée par des facteurs de transcription. Le troisième facteur, Rpd3, est une histone déacétylase. L'absence de l'un quelconque de ces trois co-répresseurs aboutit à une dérépression des transposons consécutive à une hyperacétylation de leur chromatine.
Il est intéressant de noter que, chez la levure Schizosaccharomyces pombe, des séquences non géniques, ciblées par des petits ARN non-codants, subissent un phénomène analogue de compaction chromatinienne impliquant, lui aussi, un complexe semblable de déacétylation et de remodelage de la chromatine.
Ces travaux apportent de nouvelles données sur des mécanismes épigénétiques de contrôle des transposons qui constituent plus de 45% du génome humain et dont l'expression est associée à de nombreux cancers.
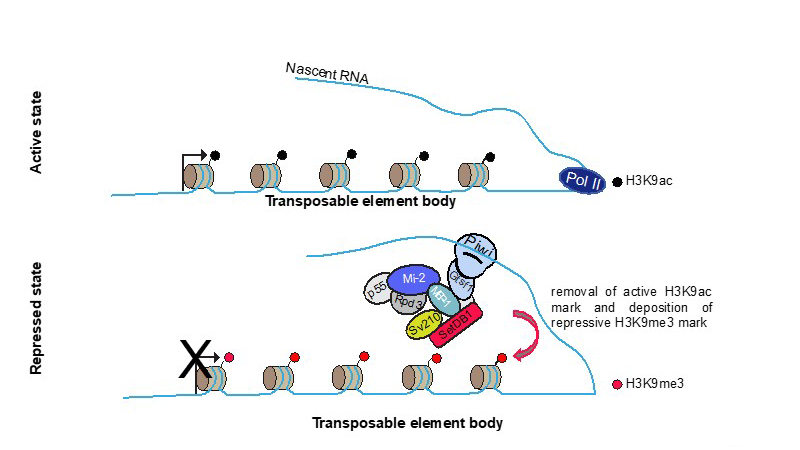
Figure : La protéine Piwi reconnait sa cible grâce à l'appariement entre le piARN qu'elle contient (trait noir) et la séquence complémentaire d'un ARN pré-messager (nascent RNA : trait bleu). Piwi apporte avec elle tout un complexe co-répresseur qui modifie la chromatine du transposon correspondant (transposable element body). Parmi les nombreuses protéines de ce complexe, la protéine Rpd3 déacétyle la lysine 9 des histones H3 (H3K9ac). Cette marque d'activation transcriptionelle est remplacée par une marque de répression (H3K9me3) qui est déposée par la protéine SetDB1. Combiné à l'action du remodeleur chromatinien Mi-2, en association avec son partenaire Mep-1, ce processus aboutit à la répression transcriptionelle du transposon.
Pour en savoir plus :
The Mi-2 nucleosome remodeler and the Rpd3 histone deacetylase are involved in piRNA-guided heterochromatin formation.
Mugat B, Nicot S, Varela-Chavez C, Jourdan C, Sato K, Basyuk E, Juge F, Siomi MC, Pélisson A, Chambeyron S. Nat Commun. 2020 Jun 4;11(1):2818. doi: 10.1038/s41467-020-16635-5. PMID: 32499524
Contact
Laboratoire
Institut de Génétique Humaine (IGH) - (CNRS/Université de Montpellier)
141 rue de la Cardonille 34396 Montpellier Cedex 5