De nouvelles molécules pour traiter les cancers du sein HER2-positifs et leurs métastases cérébrales
Dans cet article, publié dans la revue Cancer Research, les scientifiques montrent qu'une protéine, la Moesin, interagit avec l’oncogène HER2 et maintient ce dernier dans un état inactif. Dans certains cancers ("HER2-positifs") la Moesin est peu exprimée. Les chercheurs ont identifié des molécules mimant la Moesin (zuclopenthixol) et montré qu’elles pourraient permettre de cibler les cancers du sein HER2-positifs et leurs métastases cérébrales.
De 20 à 30% des cancers du sein présentent une expression aberrante de HER2, un récepteur tyrosine kinase stimulant la prolifération et la survie des cellules tumorales. Ces cancers du sein dits HER2+ sont agressifs et de mauvais pronostic clinique. Ces dernières années, le développement de thérapies ciblant HER2 reposant sur l’utilisation d’anticorps monoclonaux ou d’inhibiteurs de tyrosine kinase a permis d’améliorer considérablement le pronostic de ces cancers. Cependant, les cellules tumorales HER2+ échappent encore trop souvent à ces traitements par la mise en place de mécanismes de résistances, en favorisant par exemple l’expression de formes tronquées ou mutées de ce récepteur, résistantes aux traitements actuels. Une autre limitation est la faible capacité de ces traitements à franchir la barrière hémato-encéphalique conditionnant le ciblage des métastases cérébrales qui affectent jusqu’à 50% des patients traités pour un cancer du sein HER2+ métastatique. Le défi majeur reste donc l’identification d’agents thérapeutiques efficaces contre les formes résistantes de HER2 et les métastases cérébrales des cancers du sein HER2+.
Dans cette étude, les scientifiques montrent que le récepteur HER2 contient, dans une région non encore ciblée par les thérapies actuelles, un motif de liaison aux protéines "ERM" (Ezrin, Radixin et Moesin) qui font le lien, in vivo, entre les protéines membranaires et le squelette cellulaire. Les ERMs maintiennent ainsi HER2 dans un état inactif. Dans les cancers du sein HER2+, l’expression d’une ERM, la Moesin, est fortement réduite. Pour pallier à cette diminution, les auteurs ont conçu un crible à haut-débit reposant sur l’interaction HER2/ERM, afin d’identifier un composé chimique capable de mimer les effets des ERMs sur HER2. Ils ont ainsi identifié le Zuclopenthixol, un antipsychotique actuellement utilisé chez l’homme pour ses effets anti-hallucinatoires et sédatifs. A l’aide de lignées cellulaires normales et de cancer du sein, les scientifiques ont montré que le Zuclopenthixol, ou son analogue le Flupenthixol, inhibe l’activation de HER2, y compris de ses formes mutées et tronquées. Ils ont ensuite montré dans un modèle murin de xénogreffe orthotopique que ce composé bloque la progression tumorale des cancers du sein HER2+ et atténue considérablement la croissance de tumeurs HER2+ implantées dans le cerveau.
Ce travail montre que des molécules mimant la Moesin, tel que le zuclopenthixol, constituent une nouvelle classe d’inhibiteurs de HER2, actifs à la fois sur la tumeur primaire et sur les métastases cérébrales des cancers HER2+, et qui pourraient apporter un bénéfice important pour le traitement de ces cancers.
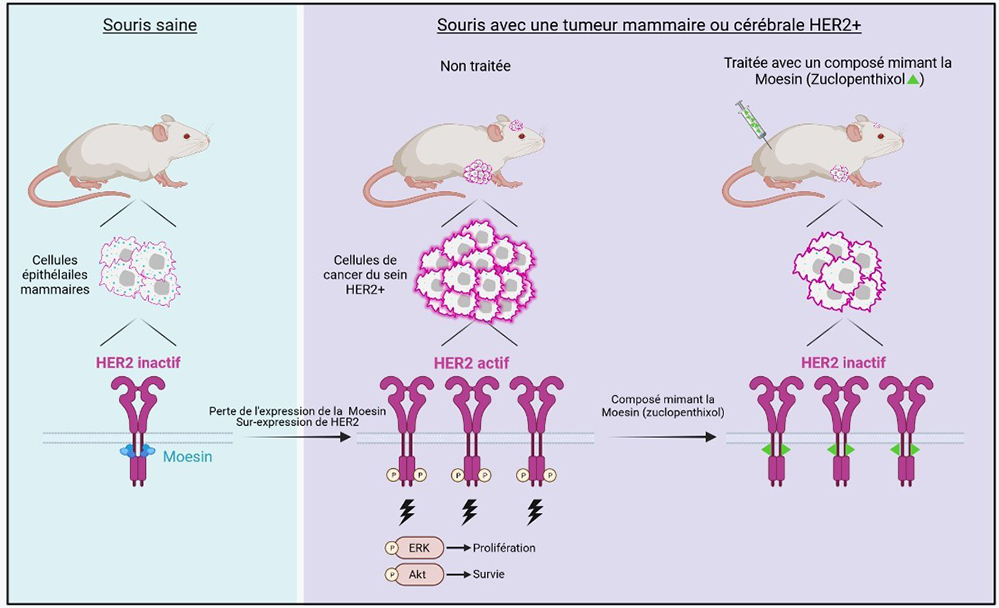
Figure : Dans les conditions physiologiques, la Moesin maintient le récepteur HER2 dans un état inactif. Dans les tumeurs mammaires HER2+, la perte de l’expression de la Moesin combinée à la surexpression de HER2 exacerbe l’activation de HER2, la prolifération et la survie des cellules tumorales. Le traitement par un composé mimétique de la Moesin permet de bloquer la progression des tumeurs mammaires HER2+ et des métastases cérébrales.
Pour en savoir plus :
Allosteric inhibition of HER2 by Moesin-mimicking compounds targets HER2-positive cancers and brain metastases
Camille Faure, Rym Djerbi-Bouillié, Anaïs Domingot, Haniaa Bouzinba-Segard, Saïd Taouji, Yanis Saidi, Sandra Bernard, Floriane Carallis, Romy Rothe-Walther, Jean-Luc Lenormand, Eric Chevet and Sandrine Bourdoulous
Cancer Res. September 7 2021. https://doi.org/10.1158/0008-5472.CAN-21-0162
Contact
laboratoire
Institut Cochin (Inserm/CNRS/Université de Paris)
22 rue Méchain
75014 PARIS