De nouvelles métalloenzymes chimériques
Dans une étude publiée dans la revue Journal of the American Society, des scientifiques ont échangé les différents sous-domaines d’une famille d’enzymes responsables de l'oxydation et de la production du dihydrogène. L’objectif est de comprendre par une stratégie d’altération des fonctions les propriétés catalytiques particulières de cette enzyme. Ces résultats ouvrent la voie à la fabrication de nouveaux outils moléculaires innovants.
Les enzymes sont des protéines essentielles dans le monde du vivant. Elles permettent de d’accélérer des réactions chimiques spécifiques nécessaires à la vie. Ces enzymes sont classées en familles, en fonction de la structure de leur site actif (organique ou inorganique), où se déroulent les réactions chimiques qu'elles catalysent. Chaque famille peut contenir plusieurs enzymes homologues, c’est-à-dire ayant une structure de site actif identique, des séquences d'acides aminés similaires, et des propriétés catalytiques différentes (notamment en ce qui concerne leur capacité à catalyser la réaction chimique dans l’une ou l’autre des deux directions, et leur résistance aux inhibiteurs).
Cette variabilité fonctionnelle illustre l’importance d’éléments structuraux éloignés des ions métalliques du site actif, qui déterminent les propriétés de l’enzyme en ayant un effet à longue distance. Lorsqu'une enzyme est un complexe de plusieurs sous-unités protéiques, il peut même arriver que ses propriétés catalytiques soient influencées par les sous-unités autres que celle qui contient le site actif.
Réassembler les sous-unités protéiques comme des LEGO ®
Pour comprendre ces effets, les scientifiques ont pris comme exemple deux hydrogénases homologues dimériques c’est à dire constituée de l'assemblage de deux sous-unité dont l’une contient le site catalytique. Ces deux enzymes catalysent l'oxydation du dihydrogène, mais l'une des deux seulement catalyse aussi la réaction inverse, celle qui permet la production d'hydrogène. Cette dernière enzyme est aussi sensible aux inhibiteurs (dioxygène, CO), qui peuvent interférer avec la capacité de l'enzyme à catalyser la réaction de production d'hydrogène. Pour déterminer laquelle des deux sous-unités est responsable de ces variations fonctionnelles, les scientifiques ont utilisé des méthodes d'ingénierie protéique pour produire une enzyme chimérique, résultant de l'assemblage non-naturel des deux sous-unités des deux dimères.
Les résultats remettent en question les dogmes concernant les déterminants moléculaires des propriétés catalytiques dans cette famille d'enzyme, et ouvrent la voie à la construction de nouveaux systèmes catalytiques, qui combineront les propriétés les plus désirables d'enzymes homologues distinctes, produits en recombinant les sous-unités qui déterminent ces propriétés.
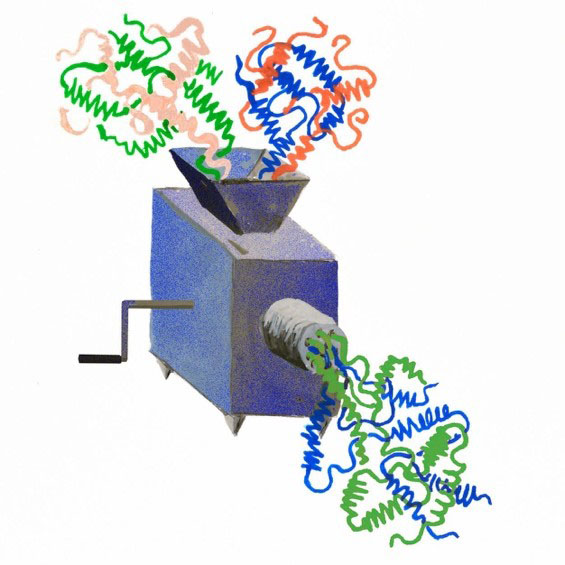
Figure : Illustration artistique de la stratégie d’ingénierie consistant à recombiner des sous-unités protéiques de complexes distincts, pour fabriquer un dimère chimérique.
En savoir plus :
A. Fasano, C. Guendon, A. Jacq-Bailly, A. Kpebe, J. Wozniak, C. Baffert, M. del Barrio, V. Fourmond, M. Brugna, C. Léger , « A chimeric NiFe hydrogenase heterodimer to assess the role of the electron transfer chain in tuning the enzyme’s catalytic bias and oxygen tolerance », J. Am. Chem. Soc. (2023). doi: 10.1021/jacs.3c06895
Contact
Laboratoire
Bioénergétique et ingénierie des protéines - BIP (CNRS/Aix-Marseille université)
31 chemin Joseph Aiguier
13402 Marseille