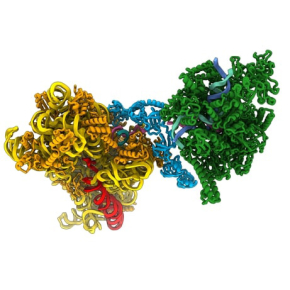
De l’ADN aux protéines : une danse moléculaire parfaitement orchestrée
L'expression des gènes implique la transcription de l'ADN en ARNm par l'ARN polymérase et la traduction de cet ARNm en protéines au sein du ribosome. Chez les bactéries, ces processus sont couplés, les ribosomes traduisant l'ARNm au fur et à mesure de sa synthèse. Dans une étude publiée dans Science, des scientifiques révèlent, à l’échelle moléculaire comment ces processus collaborent.
Transcription et traduction : un partenariat étroit chez les bactéries.
Pour exprimer l’information génétique contenue dans l’ADN, deux étapes clés se succèdent. Tout d’abord, l’ADN est transcrit en une copie temporaire appelée ARNm par une enzyme connue sous le nom d’ARN polymérase. Ensuite, le ribosome lit cet ARNm pour produire les protéines nécessaires à la cellule.
Chez les bactéries, ces processus de transcription et de traduction se produisent simultanément et à proximité, l’ARN polymérase et le ribosome étant physiquement et cinétiquement couplés. De plus, l’ARN polymérase et le ribosome peuvent réguler mutuellement leurs activités. La coopération entre ces deux machines moléculaires commence lorsque les ribosomes initient la traduction sur l’ARNm alors qu’il est encore en cours de synthèse par l’ARN polymérase. Cependant, les détails moléculaires de cette étape initiale étaient mal compris.
Découverte du rôle de la protéine bS1 dans le recrutement du ribosome.
Dans une étude, publiée dans la revue Science, les scientifiques ont examiné comment l’ARN polymérase facilite le recrutement du ribosome sur l’ARNm au cours de sa synthèse. Grâce à la microscopie électronique par cryogénie (cryo-EM), une technique qui permet de visualiser les molécules à une échelle atomique et dans leur état naturel, ils ont visualisé différents états fonctionnels de la petite sous-unité ribosomique se liant à l’ARNm naissant encore attaché à l’ARN polymérase. Ils ont découvert qu’une protéine ribosomique appelée bS1 joue un rôle essentiel : elle guide l’ARNm vers le ribosome et l’aide à trouver le point de départ pour traduire la séquence codante des protéines. Cette coordination permet une transition fluide entre transcription et traduction. Les données structurelles ont suggéré que bS1 et l’ARN polymérase travaillent ensemble pour faciliter le recrutement du ribosome sur l’ARNm.
Pour valider ces observations issues de la cryo-EM, des expériences de suivi de molécules uniques, une technique qui permet de visualiser en temps réel les interactions entre molécules individuelles, ont confirmé que la protéine ribosomique bS1 et l’ARN polymérase accélèrent ensemble le recrutement de la petite sous-unité ribosomique sur l’ARNm naissant.
De plus, grâce à la réticulation in vivo (une technique qui « fige » les interactions moléculaires dans des cellules vivantes) combinée à la spectrométrie de masse, ils ont pu prouver que les structures observées en laboratoire reflètent fidèlement ce qui se passe dans les cellules bactériennes vivantes.
Ces résultats offrent une compréhension plus claire de la coopération entre l’ARN polymérase et le ribosome pour garantir une synthèse protéique efficace et établir le couplage entre ces deux machineries essentielles.
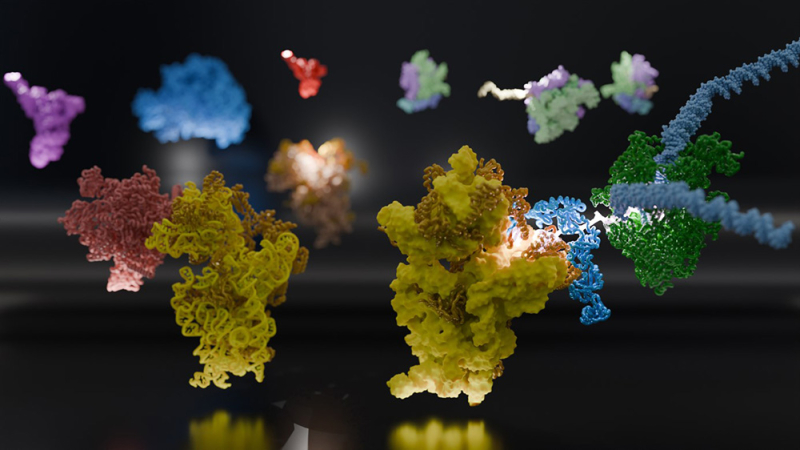
Figure : Cette image met en évidence deux voies alternatives de recrutement du ribosome sur un ARNm encore en cours de synthèse par l'ARN polymérase. L'ARN polymérase (à gauche, en rouge) peut livrer directement l'ARNm au canal d'entrée de la petite sous-unité ribosomique (à gauche, en jaune). Alternativement, et probablement de manière dominante in vivo, l'ARN polymérase (en vert) peut interagir avec la protéine ribosomique bS1 (à droite, en cyan). bS1 se lie et guide l'ARNm (à droite, blanc et brillant) de l'ARN polymérase vers le ribosome (à droite, en jaune).
En savoir plus : Molecular basis of mRNA delivery to the bacterial ribosome. Webster MW, Chauvier A, Rahil H, Graziadei A, Charles K, Miropolskaya N, Takacs M, Saint-André C, Rappsilber J, Walter NG, Weixlbaumer A. Science. 2024 Nov 29;386(6725):eado8476. doi: 10.1126/science.ado8476. Epub 2024 Nov 29. PMID: 39607923 https://www.science.org/doi/10.1126/science.ado8476
Contact
Laboratoire
Institut de génétique et de biologie moléculaire et cellulaire - IGBMC
1, rue Laurent Fries
67400 Illkirch-Graffenstaden