Comment les plantes déploient le tapis rouge pour accueillir les bactéries fixatrices d’azote
Les légumineuses peuvent se nourrir sans engrais chimique, en réalisant une symbiose avec des bactéries appelées rhizobia, pour recevoir l’azote indispensable à leur croissance. Ces échanges se réalisent dans un organe spécialisé, le nodule. Acheminer les rhizobia jusqu’au nodule est une étape clé, dont l'hôte prend les rênes en créant une route d’entrée suite à une réorganisation cellulaire complexe. Dans un article publié dans Nature Communications des scientifiques dévoilent les coulisses de ce processus et révèlent le rôle clé du calcium dans cette restructuration cellulaire complexe.
L’alliance de légumineuses avec des bactéries symbiotiques pour obtenir l’azote
Pour se procurer les nutriments essentiels à leur croissance, certaines plantes établissent des associations mutuellement bénéfiques avec des micro-organismes logés à l'intérieur de leurs cellules, sous la forme d’interactions dites « endosymbioses ». Les légumineuses en particulier, comme le pois ou le soja, sont capables de former de telles endosymbioses avec des bactéries diazotrophes, appelées collectivement rhizobia, capables de convertir, grâce à l’enzyme nitrogénase, l'azote atmosphérique en une forme organique exploitable par la plante hôte. Celle-ci, en retour, fournit des produits carbonés issus de la photosynthèse aux bactéries. Ainsi, cette symbiose permet aux légumineuses cultivées d’obtenir l’azote dont elles ont besoin, sans engrais chimiques, ce qui représente une solution durable et écologique pour l’agriculture.
L’acheminement des bactéries vers le nodule : un processus finement contrôlé
Cette interaction repose sur la création d’un nouvel organe racinaire spécialisé, le nodule, destiné à loger les bactéries symbiotiques dans un habitat optimal pour la fixation enzymatique de l’azote. L’acheminement des rhizobia vers cette niche privilégiée est une étape cruciale pour la réussite de cette symbiose. La plante hôte sélectionne d’abord le partenaire microbien compatible, avant de « dérouler le tapis rouge » pour l’accueillir. En tant que chef d'orchestre de ce processus, la plante hôte coordonne les mécanismes cellulaires chargés d’orienter le chemin d’entrée des rhizobia jusqu'à leur destination, le nodule.
Chez la plupart des légumineuses, les rhizobia sont guidées vers le nodule via une structure tubulaire néoformée, appelée cordon d'infection. Ce cordon se forme à partir d’un poil racinaire puis progresse de façon polarisée de cellule à cellule, pendant que les rhizobia se multiplient à l’intérieur. Lorsque le cordon atteint le nodule en formation, les rhizobia sont installés dans les cellules végétales et peuvent alors fixer l’azote. De nouvelles approches de microscopie résolutive, notamment in vivo chez la luzerne tronquée (Medicago truncatula), ont permis de comprendre les étapes clés qui régulent la construction et la croissance polarisée des cordons d'infection. L'hôte végétal guide non seulement la construction de cette structure, mais aussi sa direction de progression. En effet, en formant des ponts cytoplasmiques uniques devant le cordon qui s'allonge, mais aussi dans la cellule adjacente qui s’apprête à le recevoir, l’hôte détermine la trajectoire de passage du cordon d’infection. La formation de tels ponts cytoplasmiques semble être une caractéristique commune à l’accueil de microorganismes bénéfiques, puisqu’ils sont également formés pour permettre l’entrée de champignons symbiotiques, mais pas de microorganismes pathogènes.
Tuning du calcium pour engager les cellules végétales au passage des rhizobia
Malgré l'importance de cette restructuration cellulaire pour l’établissement de ces symbioses, les mécanismes sous-jacents sont restés largement méconnus, notamment en raison de la difficulté d'étudier ces réponses transitoires dans les systèmes racinaires relativement épais des légumineuses.
Dans un article publié dans la revue Nature Communications, les scientifiques ont combiné des méthodes de microscopie avancée pour explorer la formation de ponts cytoplasmiques lors de la colonisation par les rhizobia de la luzerne tronquée. Cette étude fournit des informations cruciales sur la composition ultrastructurale des ponts cytoplasmiques, enrichis de réticulum endoplasmique, de vacuoles fragmentées et de mitochondries accolées au noyau. La dynamique de ce remodelage cytoplasmique a été ensuite étudiée dans des cellules vivantes, à l'aide d'une protéine de liaison au calcium de type annexine (MtAnn1) fusionnée à un tag fluorescent, qui s'est révélée être un excellent marqueur de cette restructuration cytoplasmique in vivo. Une des découvertes marquantes a été la mise en évidence d'une relation étroite entre l'accumulation dynamique de l'annexine 1 (MtAnn1) et des signatures calciques spécifiques in vivo, uniquement dans les cellules végétales concernées par le passage des rhizobia. Ces réponses in vivo constituent alors des indicateurs précieux de la préparation des cellules végétales à l’entrée des rhizobia, et leur exploitation dans des contextes génétiques différents a permis d'identifier des régulateurs clés en amont de ce processus.
De plus, le phénotypage de mutants, a apporté des preuves supplémentaires de l’importance de l’annexine MtAnn1 pour affiner les réponses calciques et créer la configuration cytoplasmique appropriée pour une colonisation racinaire efficace des rhizobia. Enfin, des études phylogénétiques révélant le recrutement de MtAnn1 au cours de l’évolution des plantes établissant des endosymbioses racinaires avec des champignons mycorhiziens à arbuscules, suggèrent un rôle ancestral pour de telles protéines régulatrices et pour le calcium, dans l'acheminement réussi des microorganismes symbiotiques vers leurs niches d'échanges nutritionnels.
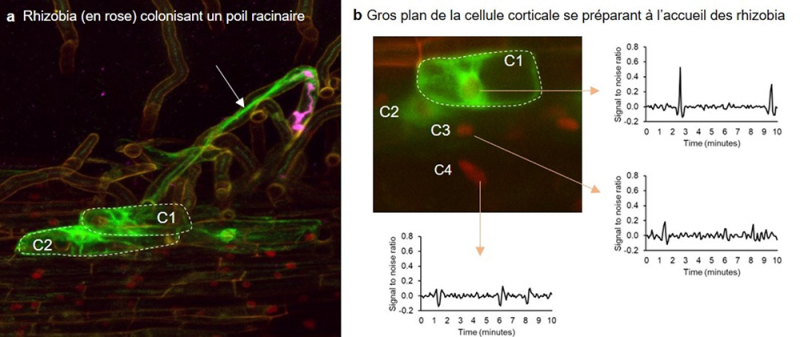
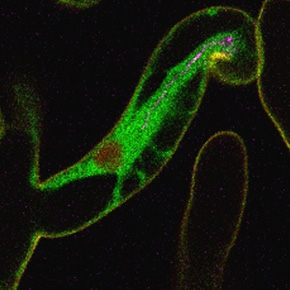
Figure : Visualisation in vivo de l'accueil des bactéries symbiotiques (rhizobia) par la plante hôte (la luzerne tronquée).
(a) Image confocale illustrant un poil racinaire épidermique colonisé (flèche) par des rhizobia (en rose) et les cellules corticales voisines (C1, C2, encadrées). Le vert correspond à la fluorescence de la protéine de fusion MtAnn1-GFP. MtAnn1 est une protéine de liaison au calcium de type annexine, et sa fusion marque les ponts cytoplasmiques du poil racinaire colonisé (flèche) ou des cellules du cortex se préparant à la colonisation par les rhizobia. Les cellules marquées par MtAnn1-GFP (en vert) montrent des signatures calciques spécifiques, à haute fréquence et basse amplitude lors de la colonisation des poils racinaires (Fig. 2, Guillory et al 2024), et à basse fréquence dans des cellules corticales se préparant à cette entrée, comme le montre le gros plan de la cellule C1 en b. Les cellules environnantes, non marquées par l'annexine (telles que C3 ou C4), ne présentent pas de signaux calciques significatifs. Images et tracés calciques sont adaptés de la Fig. 3 de Guillory et al. (2024).
Pour en savoir plus :
Annexin- and calcium-regulated priming of legume root cells for endosymbiotic infection.
Guillory A, Fournier J, Kelner A, Hobecker K, Auriac M-C, Frances L, Delers A, Pedinotti L, Le Ru A, Keller J, Delaux P-M, Gutjahr C, Frei Dit Frey N, and de Carvalho-Niebel F.
Nature Communications, 6 décembre 2024, DOI : https://doi.org/10.1038/s41467-024-55067-3
Contact
Laboratoire
Laboratoire des Interactions Plantes Microbes Environnement - LIPME (CNRS/Inrae)
INRAE
INRA/LIPM
24 Chemin de Borde-Rouge
31326 CASTANET TOLOSAN - France