Comment les jonctions serrées contribuent à déterminer la forme des organes
Les jonctions serrées sont des jonctions en forme de ceinture qui entourent la cellule. Elles assurent une étanchéité totale des tissus et jouent un rôle dans la formation en 3D des organes. Dans une étude parue dans Developmental Cell, des scientifiques ont modifié l’expression des protéines de ces jonctions et inventé des approches alliant biologie et physique pour comprendre leurs rôles.
Les jonctions serrées, indispensable à la formation en 3D des organes.
Les organes se développent par la prolifération de cellules individuelles, jointes entre elles par des jonctions cellulaires, appelées jonctions serrées. Celles-ci, qui forment des ceintures autour de la cellule, assurent l’étanchéité entre les lumières qui se forment au cours de la formation des organes et le milieu extérieur. Elles jouent donc un rôle essentiel dans la formation des cavités de fluides, les lumina, qui permettent la formation des canaux et la circulation des fluides. Mais la façon dont elles interviennent pour réguler les tensions hydrauliques et corticales ne sont pas comprises.
Dans une étude publiée dans la revue Developmental Cell, les scientifiques ont régulé l’expression de protéines des jonctions serrées entre cellules pour comprendre les règles physico-chimiques qui déterminent les formes cellulaires. De manière remarquable, certaines délétions mènent à des formes cellulaires en fleurs tandis que d’autres font ressembler les cystes à des ballons gonflés. Physiciens et biologistes se sont associés pour comprendre les mécanismes permettant de réguler ces changements de formes.
Les formes cellulaires résultent de la compétition entre pression hydrostatique et tension apicale
Pour ce faire, les scientifiques ont associé biologie moléculaire, biologie cellulaire, physique théorique, microfabrication et nouvelles approches de mesures physiques. En perçant les cystes, ils ont pu mesurer la pression présente. Par ailleurs, en coupant localement le cortex, ils ont estimé la tension corticale. Les deux mesures avec d’autres tests, ont permis d’expliquer de manière quantitative les formes des cellules et des lumina de manière inédite et sur plusieurs lignées cellulaires.
Les scientifiques se sont ensuite déplacés dans le diagramme de phase en changeant les volumes de lumens de manière contrôlée. Ils ont confirmé leurs hypothèses en reproduisant les phénotypes, montrant ainsi comment la régulation de l’expression des protéines de jonctions peut changer les formes des cellules et des organes.
Ce projet réalisé dans le cadre d’un réseau ‘Human Frontier Science Program‘ permet de comprendre des règles fondamentales pour la formation des tissus en 3D. Ces résultats pourraient aussi donner de nouvelles idées pour concevoir et réguler les dynamiques d’organes artificiels en trois dimensions.
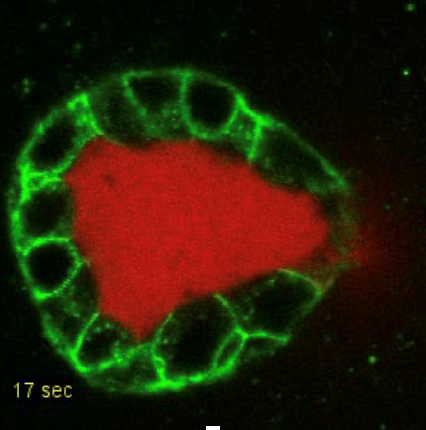
Légende :
Mesure de pression hydrostatique par perçage local d’un cyste MDCK. En rouge la mucine, en vert les contours cellulaires ; le perçage local entraîne l’écoulement du liquide et permet la mesure de la pression hydrostatique. Épaisseur cellulaire 10mm.
Pour en savoir plus :
Tight junctions control lumen morphology via hydrostatic pressure and junctional tension
Markus Mukenhirn, Chen-Ho Wang, Tristan Guyomar, Matthew J. Bovyn, Michael F. Staddon, Riccardo Maraspini, Linjie Lu, Cecilie Martin-Lemaitre, Masaki Sano, Tetsuya Hiraiwa, Daniel Riveline*, Alf Honigmann*
Tight junctions regulate lumen morphology via hydrostatic pressure and junctional tension
Developmental Cell, 12 août 2024.
Contact
Laboratoire
Institut de génétique et de biologie moléculaire et cellulaire - IGBMC (CNRS / Inserm / Université de Strasbourg)
1 Rue Laurent Fries
67404 ILLKIRCH CEDEX
