Comment la séparation de phases aide à la ségrégation du matériel génétique
A l’instar des gouttes d’huile dans l’eau, le processus de séparation de phases en condensats est maintenant reconnu comme essentiel pour la compartimentalisation des composants de la cellule en l'absence de membrane. En utilisant des techniques de microscopie de fluorescence avancées, les scientifiques montrent que des moteurs moléculaires permettent de séparer et positionner des condensats transportant du matériel génétique à l'intérieur de la cellule. Ces résultats, publiés dans la revue Molecular Cell, décrivent un nouveau mécanisme actif qui transporte, divise, déplace et positionne les condensats et qui assure ainsi leur transmission lors de la division cellulaire.
Il est bien connu que les cellules compartimentent leurs composants à l’intérieur de membranes (noyau, réticulum endoplasmique, mitochondries, etc..) afin de concentrer et localiser les réactions biochimiques. C’est par contre seulement depuis peu que l’on sait que la cellule peut organiser ses composants d’une manière plus originale et sans doute plus flexible : par la séparation de phases. La Séparation de Phases, par exemple Liquide-Liquide (SPLL), est connue au quotidien en mélangeant deux composants non miscibles, tels que l’huile et l’eau. De petites gouttelettes/condensats se forment alors et finissent par se rassembler pour ne former à l’équilibre que deux phases: l’huile d’un côté et l’eau de l’autre. Il a été démontré que ce mécanisme est au service de nombreux processus biologiques fondamentaux tels que la régulation de réactions biochimiques, la séquestration des facteurs toxiques ou plus généralement à l’organisation subcellulaire. Ainsi, la SPLL semble être un mécanisme universel pour compartimenter dans la cellule les composants en l'absence de membranes. Cependant, une question clé reste de savoir comment la cellule organise et positionne ces condensats dans l'espace sous-cellulaire.
Pour aborder cette question fondamentale dans le domaine des SPLL, les scientifiques se sont concentrés sur le système de partition ParABS, responsable de la ségrégation des chromosomes et des plasmides chez les bactéries et les archées. Ce système est composé de trois éléments :
(1) une séquence ADN centromérique (parS) ; (2) une protéine de liaison à l'ADN (ParB) ; et (3) une protéine motrice alimentée par l'ATP (ParA). En combinant les outils d’analyse de la microscopie électronique avec la spécificité de marquage de la microscopie de fluorescence à super-résolution ils ont tout d’abord révélé que la grande majorité des protéines ParB dans la cellule est concentrée dans des gouttelettes sphériques extrêmement petites (taille nanométrique). En suivant la dynamique de ces protéines une par une, les chercheurs ont constaté que leur diffusion est considérablement réduite dans les gouttelettes et que les protéines transitent rapidement pour rejoindre les gouttelettes voisines. Ces expériences ont permis une caractérisation quantitative de la dynamique et de la taille des gouttelettes à l’échelle de la molécule unique. Les résultats obtenus montrent que la dynamique des protéines ParB est conforme avec une séparation de phase de type liquide-liquide.
Les scientifiques ont également montré que ces gouttelettes nécessitent une séquence bien particulière de l’ADN afin de nucléer: la séquence centromérique parS. Pour cela, ils présentent un cadre théorique qui récapitule entièrement la phénoménologie expérimentale et définit un nouveau mécanisme pour cibler et accélérer de manière robuste la nucléation des gouttelettes à des endroits spécifiques du génome. Le modèle théorique proposé suggère en effet que la relocalisation des séquences de nucléation est suffisante pour relocaliser les gouttelettes. Ainsi, ce mécanisme peut avoir des implications importantes pour de nombreux systèmes où la SPLL est pertinente, par exemple pour comprendre son rôle dans l'organisation et la régulation du génome eucaryote (e.g. l'hétérochromatine).
Enfin, les chercheurs montrent que les gouttelettes de ParB peuvent être divisées et positionnées de manière robuste à des endroits spécifiques de la cellule, et séparées par un mécanisme actif qui utilise l'énergie chimique d’hydrolyse de l’ATP. Notamment, la dégradation de la protéine motrice ParA empêche la ségrégation des gouttelettes et conduit à leur agrégation irréversible. Des mécanismes similaires pourraient être en jeu dans les systèmes eucaryotes, ouvrant ainsi de nouvelles voies d'exploration. Par exemple, des systèmes similaires peuvent agir dans la localisation subcellulaire des domaines de l'hétérochromatine et dans leur division pendant la transcription ou après la réplication, dans la division et la propagation des gouttelettes dans les protocellules prébiotiques, ou dans la localisation des granules P, des granules de stress, des corps cajal ou des granules de transport d'ARN messager.
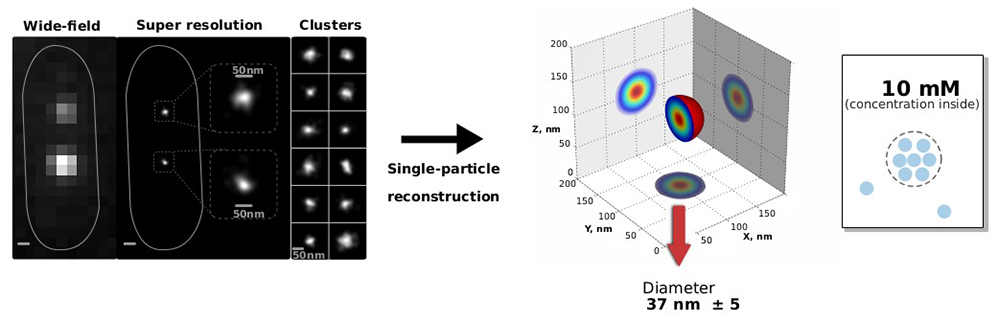
Figure : (Gauche) Complexes de partition visualisés par la microscopie de super-résolution (PALM), et classifiés par analyse de particules uniques. (Centre) Reconstruction de la structure 3D des gouttelettes de ParB. (Droite) Schéma du processus de formation de gouttelettes par ParB.
Pour en savoir plus:
ATP-Driven Separation of Liquid Phase Condensates in Bacteria
Guilhas B, Walter JC, Rech J, David G, Ole Walliser N, Palmeri J, Mathieu-Demaziere C, Parmeggiani A, Bouet JY, Le Gall A, Nollmann M
Molecular Cell 16 July 2020. https://doi.org/10.1016/j.molcel.2020.06.034
Contact
Laboratoire
Centre de Biochimie Structurale (CBS) - (CNRS/Inserm/Université de Montpellier)
60 rue de Navacelles, 34090 Montpellier, France