Comment croître plus grand et plus vite
La croissance cellulaire est étroitement régulée, ce qui est critique dans une communauté de cellules comme un biofilm. De telles communautés sont essentielles au "succès" des infections, y compris celles causées par le champignon pathogène opportuniste de l’Homme Candida albicans. Comment la taille des cellules et la vitesse de croissance sont-elles alors maintenues? En utilisant une combinaison de mutants et d'interactions physiques synthétiques, les scientifiques montrent que la sous-unité régulatrice d'un moteur moléculaire de la myosine joue un rôle clé dans le maintien de la robustesse de croissance de ce pathogène. Ce travail est publié dans la revue mBio.
Nombre de cellules allongées se développent par extension à une extrémité, l’apex, ce qui leur permet d'explorer leur environnement, en particulier de rechercher des nutriments ou des partenaires, ou d'échapper aux cellules immunitaires de l'hôte. Par exemple, un champignon pathogène qui reçoit des signaux chimiques provenant des cellules hôtes va réguler sa croissance en conséquence, pour proliférer abondamment et/ou pour adhérer et envahir les couches tissulaires. Les champignons pathogènes tels que C. albicans sont unicellulaires, mais ils se développent également sous forme de filaments qui sont des chaînes de cellules connectées pouvant se ramifier. La croissance de ces communautés cellulaires complexes nécessite une coordination de la taille des cellules, de la morphologie et de la vitesse d'extension des filaments.
De nombreuses études, utilisant en particulier des mutants "perte de fonction", ont permis d'identifier des gènes essentiels à la croissance filamenteuse de C. albicans. Ces mutants ont en général une vitesse de croissance filamenteuse réduite. Pour étudier le lien entre trafic membranaire, organisation intracellulaire et vitesse d'extension des filaments, les chercheurs ont examiné la fonction d'un régulateur d'une protéine motrice, en utilisant à la fois une approche "perte de fonction" mais aussi une approche "nanobodies" dans laquelle un mini-anticorps (dAb de lama) est utilisé pour associer de façon irréversible deux composants cellulaires.
Cette stratégie a permis aux chercheurs d'étudier la conséquence d'une liaison constitutive entre composants de la voie de sécrétion ainsi que de cibler un de ces composants à la membrane plasmique de C. albicans. Étonnamment, ces mutants produisent des filaments plus larges et qui poussent plus rapidement. De plus, si dans une population de cellules sauvages toutes les cellules se développent à un rythme très similaire et ont un diamètre presque identique, dans ces différents mutants, une large variété de diamètres de filaments et de vitesses de croissance a été observée, avec une corrélation entre diamètre du filament et vitesse d'extension, c’est-à-dire que les filaments plus larges poussent plus vite. Une telle corrélation a été prédite il y a plus de 30 ans dans un modèle mathématique de croissance fongique et nos travaux indiquent que le moteur moléculaire qui transporte les vésicules de sécrétion jusqu'à l'apex du filament joue un rôle clé dans la relation entre taille des cellules et vitesse de croissance.
Cette étude révèle que la régulation étroite d’un moteur moléculaire clé garantit une croissance similaire des cellules filamenteuses dans une communauté, ce qui est vraisemblablement critique pour le développement fongique et l'infection.

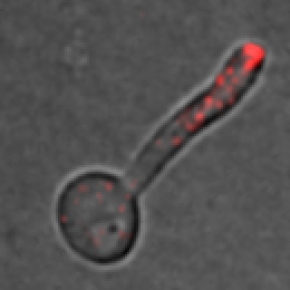
Figure : Croissance filamenteuse d'un mutant de la chaîne légère de la myosine (mlc1) de Candida albicans. Les noyaux (en vert) sont visualisés avec un marqueur nucléolaire fusionné à GFP, l’accumulation de vésicules de sécrétion (en rouge), appelée Spitzenkörper, avec un marqueur de Rab GTPase fusionné à RFP et la paroi cellulaire/jonctions cellulaires (septa) (en cyan) avec le marqueur de chitine Calcofluor white.
Légende : Associer de façon irréversible la chaîne légère de la myosine (Mlc1) avec la membrane plasmique augmente la taille des filaments et leur vitesse de croissance chez C. albicans. GFP ciblée a la membrane plasmique (en vert) et associée avec Mlc1. Images tous les 10 min.
Pour en savoir plus :
A Myosin Light Chain Is Critical for Fungal Growth Robustness in Candida albicans.
Puerner C, Serrano S, Wakade R S, Bassilana M, Arkowitz RA
mBio. 26 Oct 2021. DOI: 10.1128/mBio.02528-21
Contact
laboratoire
Institut de Biologie Valrose (iBV) (CNRS / Inserm / Université Côte d'Azur)
06108 Nice Cedex 2