Choc septique : une nouvelle approche thérapeutique ?
Le sepsis est une réponse inflammatoire en réaction à une infection qui peut évoluer vers un choc septique, cause encore fréquente de décès. Dans un article publié dans la revue Nature Microbiology, les scientifiques relatent la découverte d’une molécule qui, dans un modèle murin, réduit considérablement les effets du choc septique, ouvrant ainsi la porte à de nouvelles perspectives thérapeutiques.
Les cellules endothéliales cibles de la réponse inflammatoire lié au sepsis.
Le sepsis est une maladie très fréquente due à réponse inflammatoire généralisée de l’organisme en réaction à une infection, dont la forme la plus grave, le choc septique, reste une cause fréquente de décès. Grâce aux nombreux progrès de la médecine, cette mortalité diminue, mais elle reste néanmoins très élevée, représentant environ 11 millions de décès par an dans le monde. Les patients qui survivent souffrent de graves séquelles. Avec le vieillissement de la population, le nombre de cas de sepsis devrait doubler au cours des cinquante prochaines années. Dans ce contexte, la recherche de pistes thérapeutiques constitue un enjeu majeur de santé publique.
Traduction en Français. Les cellules endothéliales, qui tapissent les vaisseaux sanguins, sont l’une des premières cibles de la réponse inflammatoire liée au sepsis. Les fonctions endothéliales sont affectées entraînant une modification du tonus vasculaire, une augmentation de la perméabilité vasculaire, une coagulation disséminée et une exacerbation de la réponse inflammatoire. Cette atteinte, qualifiée de dysfonction endothéliale, diminue l’oxygénation des tissues, contribuant à l’apparition du syndrome de défaillance multiviscérale. En conséquence, de nombreuses études ont été menées ces dernières années pour prévenir cette dysfonction endothéliale et/ou restaurer la fonction endothéliale afin de limiter la défaillance d’organes et améliorer le pronostic des patients en choc septique. Cependant, il n’y a, à ce jour, aucune molécule apportant un bénéfice thérapeutique sur la dysfonction endothéliale.
Les cellules endothéliales du cerveau peuvent résister aux infections systémiques.
Pour identifier de nouvelles molécules permettant de prévenir cette dysfonction endothéliale les scientifiques se sont intéressés aux cellules endothéliales du cerveau. Ces cellules spécialisées forment une barrière fortement restrictive entre le sang et le cerveau (appelée barrière hémato-encéphalique) qui régule étroitement l’homéostasie cérébrale et protège le parenchyme cérébral contre les infections systémiques. Ils ont observé que les cellules endothéliales des vaisseaux cérébraux, à la différence des cellules endothéliales des vaisseaux périphériques, expriment des facteurs intrinsèques leur permettant de résister à une infection par Neisseria meningitidis (également connue sous le nom de méningocoque). Cette bactérie redoutable est responsable d’une forme très sévère de sepsis, caractérisée par une fuite vasculaire, une coagulation intravasculaire disséminée, et l’apparition de lésions purpuriques conduisant à une nécrose cutanée et la mort chez 30 % des patients (purpura fulminans).
Un facteur responsable de cette résistance identifié et prometteur.
Parmi les facteurs spécifiquement exprimés par les cellules endothéliales cérébrales leur permettant de résister au méningocoque, les chercheurs ont identifié l’Angiopoïetin-Like 4 (ANGPTL4), et montré que cette glycoprotéine sécrétée, est un facteur clé de stabilisation vasculaire qui protège la barrière hémato-encéphalique des agressions bactériennes.
Ces résultats ont mené les chercheurs à envisager le recours à l’ANGPTL4 comme piste thérapeutique pour prévenir la dysfonction endothéliale dans le sepsis. Ils ont ainsi montré, dans des modèles murins de sepsis induit par une endotoxine bactérienne ou de purpura induit par le méningocoque, que l’injection d’ANGPTL4 réduit considérablement la dysfonction vasculaire et les symptômes associés : fuite vasculaire, coagulation intravasculaire, production des effecteurs de l’inflammation, ainsi que la dysfonction d’organes vitaux, tels que les poumons et les reins, et finalement le taux de mortalité des souris. Enfin, les scientifiques ont montré que cette protection est conférée par un domaine encore non caractérisé de l’ANGPTL4, situé dans sa partie N-terminale, par liaison à un récepteur endothélial, l’héparane protéoglycane Syndecan-4.
Après ces résultats très encourageants, ils poursuivent leurs travaux dans la perspective d’utiliser en clinique un peptide dérivé de l’ANGPTL4 pour limiter la dysfonction endothéliale chez les patients en choc septique et ainsi améliorer leur prise en charge.
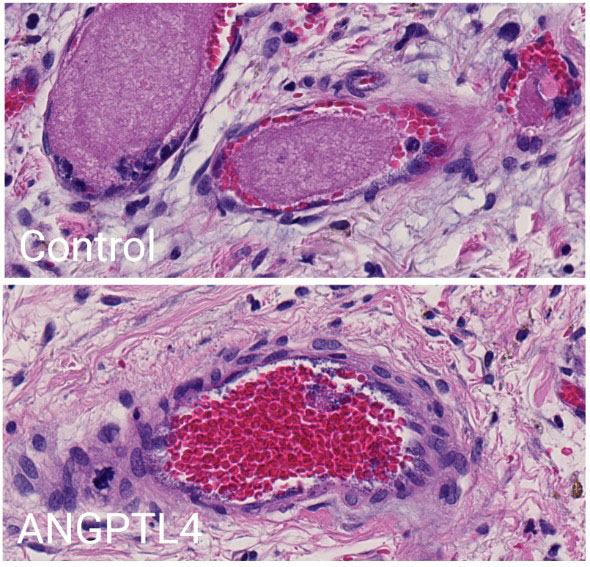
Figure : Un traitement par l’ANGPTL4 prévient la formation de thrombi occlusifs dans les vaisseaux de derme humain infectés par Neisseria meningitidis.
Coloration à l'hématoxyline et à l'éosine de peau humaine infectée par Neisseria meningitidis. Haut : contrôle non traité. Bas : Traité par l’ANGPTL4.
En savoir plus :
Angiopoietin-like 4 protects against endothelial dysfunction during bacterial sepsis.
J. Ziveri, L. Le Guennec, I. dos Santos Souza, J.-P. Barnier, S. M. Walter, Y. Diallo, Y. Smail, E. Le Seac’h, H. Bouzinba-Segard, C. Faure, P. C. Morand, I. Carel, N. Perriere, T. Schmitt, B. Izac, F. Letourneur, M. Coureuil, T. Rattei, X. Nassif, S. Bourdoulous.
Nature Microbiology, 5 août 2024. 10.1038/s41564-024-01760-4
Contact
Laboratoire
Institut Cochin (CNRS / Inserm / Université Paris Cité)
22 rue Méchain
75014 Paris