Chez la souris, l’interféron-alpha améliore l'immunothérapie par les anticorps anti-PD-1
Dans un modèle murin, les scientifiques ont mis en évidence un mécanisme améliorant l'efficacité anti-tumorale d'un traitement immunothérapique par des anticorps anti-PD-1 pour prévenir les rechutes de cancer. Une association avec l’interféron-alpha semble mobiliser lymphocytes T et macrophages pour mieux lutter contre les échappements tumoraux. Ce travail est publié dans la revue Journal for Immunotherapy of Cancer
Aujourd’hui, l’immunothérapie est perçue comme l’approche la plus prometteuse dans le traitement des cancers. Malgré des avancées significatives, de nombreux patients doivent faire face à des phénomènes d'échappement après une première phase de rémission. Il est donc important de comprendre comment ces rechutes tumorales peuvent être prévenues.
Les chercheurs ont mis au point, dans un modèle murin, une nouvelle stratégie thérapeutique basée sur la mobilisation, de manière opportune, des cellules myéloïdes au côté des cellules T, afin de rétablir un microenvironnement inflammatoire nécessaire pour la lutte anti-tumorale. Pour y parvenir, ils ont développé un modèle de rechute tumorale. Celui-ci repose sur l’implantation de tumeurs chez des souris auxquelles est ensuite administré un traitement volontairement peu efficace, de sorte que dans 70% des cas, une régression partielle et transitoire est suivie de rechute. Ils ont alors appliqué un traitement immunothérapique considéré comme un des plus prometteurs : l'administration d'anticorps anti-PD-1, qui vise à augmenter l'efficacité, notamment cytotoxique, de cellules T anti-tumorales. L'administration d'anti-PD-1 à la veille de la rechute tumorale améliore la survie de certaines souris, mais pas pour la majorité.
Afin d'améliorer l'efficacité de l'anti-PD-1, les chercheurs, à rebours de la pensée scientifique dominante, ont parié sur la coopération cellulaire plutôt que la compétition entre des cellules du système immunitaire (notamment entre cellules T et macrophages). Ainsi, au lieu d’éliminer les macrophages pour améliorer le traitement anti-PD1, ils ont préféré les activer. Pour ce faire, ils ont choisi de combiner l'anti-PD-1 donné en systémique, et une injection locale (péritumorale) d'interféron alpha (IFNa), molécule présumée alerter le système immunitaire de la présence d'une infection locale.
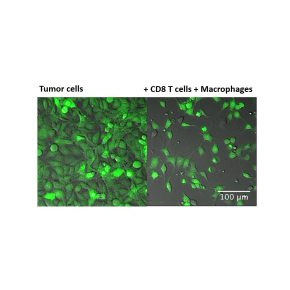
Enfin, ils ont privilégié une injection péri-tumorale d'IFNa pour attirer localement, vers la tumeur, des cellules cytotoxiques, plutôt q'une injection systémique connue pour avoir des effets adverses indésirables (ces effets sont bien moindres avec une injection locale). L’administration de ce traitement, après la phase de régression initiale, réduit drastiquement le taux de rechute, qui passe de 70% à 14%. Les anti-PD-1 seuls ou l'IFNa seul ont un effet bien moindre, avec 40% de rechutes environ dans chaque cas. D’un point de vue mécanistique, cette combinaison thérapeutique permet d’augmenter le nombre de cellules T et des monocytes/macrophages activés au site tumoral, ainsi que leur activité cytotoxique. Ces résultats mettent en lumière la nécessité d’activer divers effecteurs immuns anti-tumoraux pour qu'ils puissent coopérer et éliminer plus efficacement une tumeur.
Certes, ces résultats ont été obtenus chez la souris, et d'autres travaux seront nécessaires, mais plusieurs éléments de cette stratégie ont montré leur pertinence dans ce modèle murin, ouvrant des pistes à poursuivre pour améliorer l'efficacité clinique des traitements anti-PD-1 existants.
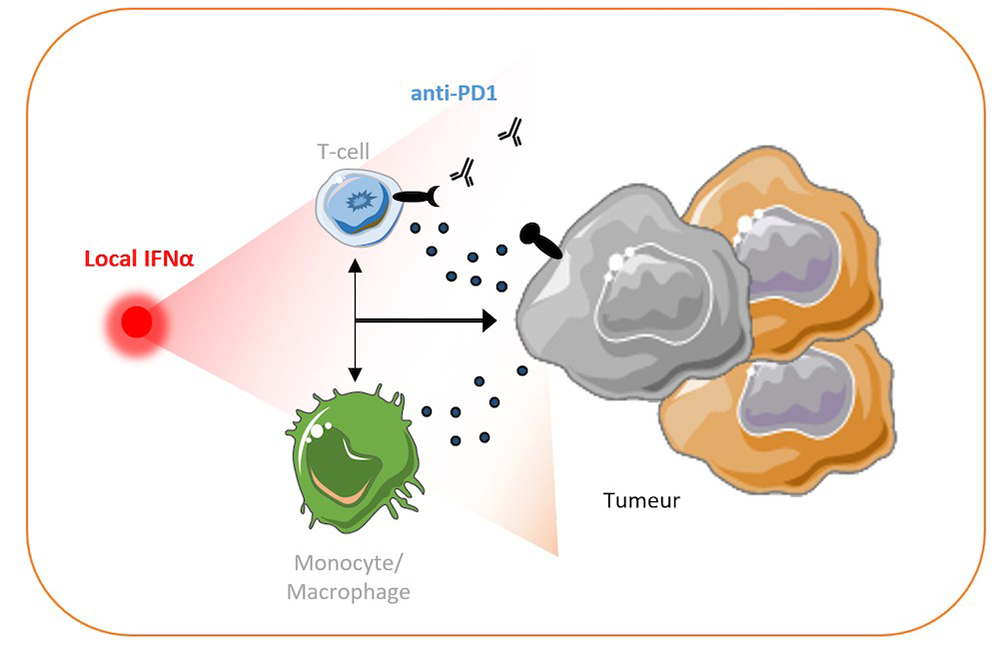
Figure : L’administration d’anti-PD1 en systémique associée à l’injection locale d’ IFNa en péri-tumorale à la veille de la rechute tumorale, permet le recrutement et l’activation de cellules myéloïdes et de lymphocytes T, qui ensemble, empêchent la rechute de la tumeur.
Pour en savoir plus :
Local IFNα enhances the anti-tumoral efficacy of systemic anti-PD1 to prevent tumor relapse.
Guerin MV, Regnier F, Thoreau M, Vimeux L, Benard M, Dransart E, Penny HL, Johannes L, Trautmann A, Bercovici N.
J Immunother Cancer. 8 Nov 2020. doi: 10.1136/jitc-2020-000996.
Contact
Laboratoire
Institut Cochin - (CNRS, Inserm, Université de Paris)
22 rue Méchain, 75014 Paris