Caractérisation de deux molécules modulant la contraction cardiaque : un pas de plus vers la médecine de précision
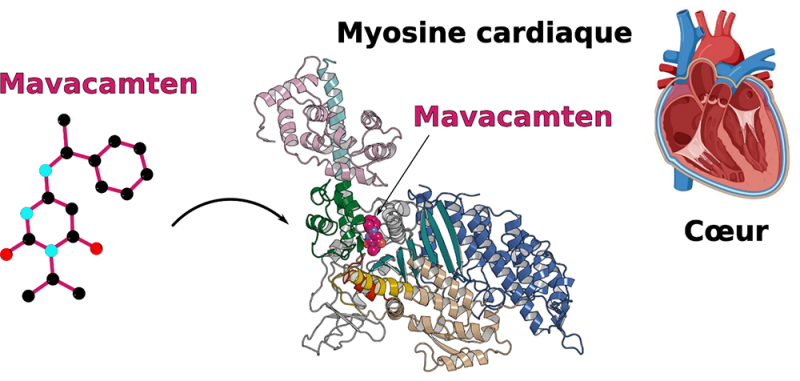
Les cardiomyopathies hypertrophiques familiales (CHF) sont des maladies cardiaques causées par des mutations exprimées au niveau des myosines, protéines responsables de la contraction du cœur, et qui sur le long terme, peuvent entraîner des insuffisances cardiaques. Dans un article publié dans la revue Nature Communications, les scientifiques révèlent des informations cruciales sur le mode d’action de Mavacamten, une molécule d’intérêt thérapeutique récemment approuvée par la FDA. Cette recherche de pointe ouvre la voie au développement d’une médecine de précision contre les maladies cardiaques.
Les CHF sont un problème de santé publique touchant environ une personne sur 500. D’un point de vue clinique, ces maladies se manifestent par des contractions anormales du cœur qui entraînent, à la longue, des insuffisances cardiaques.
« Ces contractions anormales sont dues à la présence de mutations s’exprimant au niveau des fibres musculaires contractiles appelées myosines, jouant le rôle de moteur de la pompe. Nous savons qu’il existe plusieurs centaines de ces mutations aujourd’hui, avec des effets moléculaires différents, mais des symptômes similaires. » explique le Dr Julien Robert-Paganin.
Les traitements proposés aujourd’hui reposent sur des chirurgies invasives, allant jusqu’à la transplantation cardiaque dans les phases tardives de la maladie, avec de lourdes conséquences sur la qualité de vie des patients.
« Une question se pose face à ces données : est-il possible de développer des médicaments capables de rectifier la force de contraction du cœur en modulant directement l’activité de la myosine ? » poursuit Anne Houdusse.
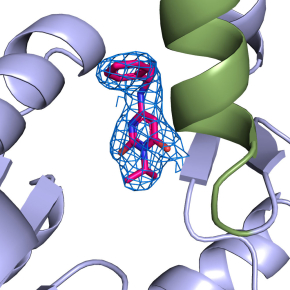
Deux molécules ont ces effets : l’Omecamtiv mecarbil qui active la contraction des myosines, et le Mavacamten, qui l’inhibe. Afin de comprendre comment ces molécules médient leurs effets opposés, les scientifiques ont utilisé la cristallographie aux rayons X pour identifier le site de liaison sur la myosine. L’étude révèle que ces deux molécules, malgré des effets inverses sur la contraction de la myosine, se lient pourtant exactement au même endroit sur la fibre musculaire. Des études poussées de dynamique moléculaire, permettent de montrer comment ces deux médicaments médient leurs effets opposés. En effet, leur cible étant la même, les molécules n’ont cependant pas la même mobilité et stabilité dans la poche, interagissant différemment avec le domaine moteur de la myosine, expliquant leurs actions inverses.
En plus d’en soigner les symptômes, ces molécules se révèlent en mesure de ralentir la progression de la maladie. L’épaississement de la paroi du cœur, à l’origine des complications à long-terme, est dû à la force anormale de contraction des muscles cardiaques. Des études ont montré qu’en rectifiant cette force, les parois sont moins endommagées, suggérant que la prise de ce type de médicament dans les phases précoces de la maladie peut diminuer les risques de développer des insuffisances cardiaques.
Pour la suite de ce projet, les scientifiques continuent à combiner l’étude structurale à l’analyse des dynamiques moléculaires pour caractériser d’autres molécules thérapeutiques.
« Notre équipe compare également le mode d’action d’autres molécules d’intérêt thérapeutique. Dans l’optique de développer une médecine de précision, il faut maintenant tester l’efficacité de ces médicaments pour diverses maladies cardiaques » indique Julien Robert-Paganin.
Ils ont pour objectif de mieux comprendre comment la contraction musculaire est contrôlée pour diversifier les molécules d’intérêt capables de moduler la force produite.
« Cette étude est une étape clé dans notre compréhension des modulateurs de fonction des moteurs moléculaires. Alors que Mavacamten vient tout juste d’être accessible aux patients, notre recherche apporte une connaissance indispensable pour informer les médecins sur son mode d’action et mieux conseiller sur les traitements révolutionnaires futurs qui sont aujourd’hui en phase clinique 3 pour les maladies cardiaques. » conclut Anne Houdusse.
Pour en savoir plus :
Omecamtiv mecarbil and Mavacamten target the same myosin pocket despite antagonistic effects in heart contraction
D. Auguin, J. Robert-Paganin, S. Réty, C. Kikuti, A. David, G. Theumer, A. W. Schmidt, H.-J. Knölker, A. Houdusse
Nature Communications, 7 juin 2024, https://doi.org/10.1038/s41467-024-47587-9
Contact
Laboratoire
Biologie cellulaire et cancer (CNRS / Institut Curie)
26 Rue d'Ulm
75248 PARIS CEDEX 05 - France