Bases moléculaires de la maladie de Parkinson et autres synucléinopathies
L’agrégation de la protéine alpha-synucléine est à l’origine de différentes maladies appelées synucléinopathies, dont la maladie de Parkinson. Comment l’agrégation d’une même protéine conduit à différentes maladies est un mystère. L’analyse des propriétés d’agrégats de la protéine alpha-synucléine provenant de différentes synucléinopathies établie des bases moléculaires à ces différentes maladies. Ces résultats sont publiés dans la revue Acta Neuropathologica.
L’agrégation de la protéine alpha-synucléine est responsable de la maladie de Parkinson, de la démence à corps de Lewy et de l’atrophie multisystématisée.
Dans le cadre d'une collaboration internationale, les scientifiques viennent d’établir que des agrégats de cette protéine provenant du cerveau de malades et qui ont été amplifiés in vitro diffèrent à l’échelle moléculaire. Ils ont en quelques sorte des codes barre moléculaires distincts qui sont à présent identifiés. Ces agrégats entrainent chez des rongeurs des caractéristiques propres à chaque maladie. Certains entraînent une progression de la pathologie rapide, d’autres une évolution lente. Comme pour différents virus ou souches d’un virus, la progression de la pathologie et les régions du cerveau affectées dépendent des propriétés structurales des agrégats de l’alpha-synucléine. Ces résultats ont été obtenus en combinant des techniques de biochimie à l’expérimentation animale et l’analyse comportementale des animaux.
En plus d’apporter une meilleure compréhension de l’agrégation de l’alpha-synucléine et d’établir un modèle animal ouvrant la voie à des validations de stratégies thérapeutiques, ce travail établit des bases moléculaires pour identifier ces maladies avec certitude. A ce jour, les essais cliniques n’ont pas permis de découvrir des traitements curatifs pour les différentes synucleinopathies. Cela est en partie dû à une la catégorisation imparfaite des patients. En établissant des bases moléculaires robustes pour différentes synucléinopathies, ce travail pourrait augmenter les chances de succès d’essais cliniques vers des stratégies thérapeutiques pour ces maladies.
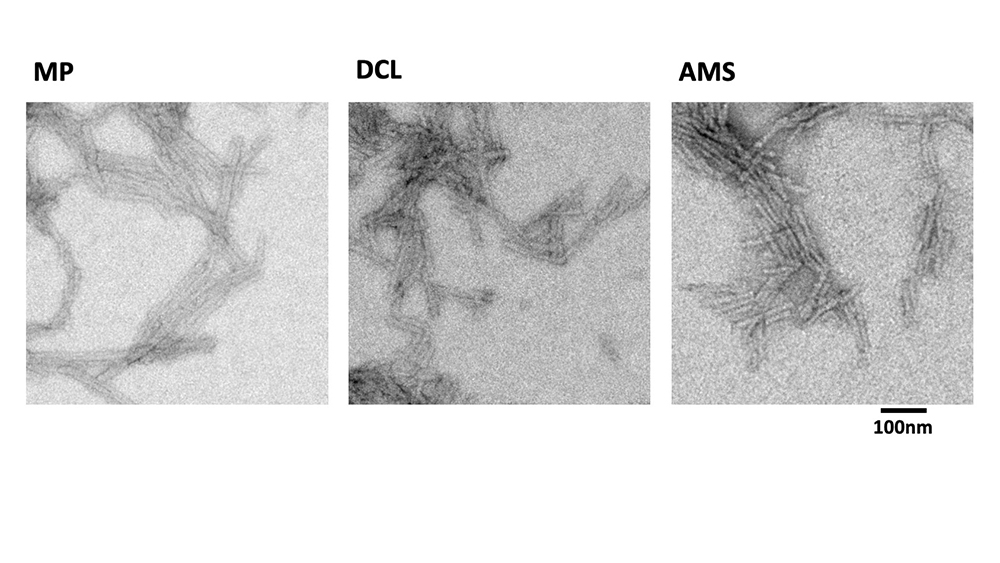
Figure : Agrégats fibrillaire de la protéine alpha-synucléine multipliés à partir de cerveaux de malades observés au microscope électronique. Des agrégats de la protéine alpha-synucléine présents dans le cerveau d’individus ayant développé la maladie de Parkinson, la démence à corps de Lewy et l’atrophie multisystématisée fibrillaires ont étés utilisés comme amorces et ont étés multipliés au laboratoire dans des tubes à essais. Cela a permis de montrer qu’ils sont distincts biochimiquement. Les agrégats caractéristiques de la maladie de Parkinson (MP), démence à corps de Lewy (DCL) et de l’atrophie multisystématisée (AMS) sont dissemblables comme montré ici par leur observation au microscope électronique. Cela a permis par ailleurs d’en produire suffisamment pour analyser leurs propriétés pathogéniques dans un modèle animal des synucléinopathies. La barre noire à droite représente un dix-millionième de mètre (ou 100 nanomètres).
Pour en savoir plus :
The structural differences between patient-derived α-synuclein strains dictate characteristics of Parkinson’s disease, multiple system atrophy and dementia with Lewy bodies
Van der Perren A, Gelders G, Fenyi A, Bousset L, Brito F, Peelaerts W, Van den Haute C, Gentleman S , Melki R, Baekelandt V.
Acta Neuropathologica 30 avril 2020. https://doi.org/10.1007/s00401-020-02157-3
Contact
Laboratoire
Laboratoire des maladies Neurodégénératives (LMN) - (CNRS/Institut François Jacob/CEA/Université Paris-Saclay)
18 Route du Panorama, 92265 Fontenay-Aux-Roses cedex, France
