La cycline A2, qui maintient l'homéostasie du côlon, est un facteur de pronostic dans le cancer colorectal
Le cancer colorectal, un problème de santé publique majeur, nécessite l'identification de nouveaux biomarqueurs et cibles thérapeutiques. Les scientifiques ont combiné l’analyse de modèles murins et une méta-analyse transcriptomique du CCR pour évaluer le rôle de la cycline A2 dans ce dernier. Bien que des niveaux élevés de cycline A2 aient fréquemment été associés à un mauvais pronostic chez les patients cancéreux, cette étude montre que les niveaux élevés de CCNA2 (l'ARNm codant pour la cycline A2) peuvent représenter un marqueur pronostic favorable dans le CCR. Ce travail est publié dans le Journal of Clinical Investigation.
Le cancer colorectal (CCR) est l'une des principales causes de décès pathologique dans le monde avec une incidence croissante. L'état pathologique des patients peut être classé en fonction du grade histologique de la tumeur (différenciation) et de l'étendue anatomique de la maladie (c.-à-d. la classification TNM, pour tumeurs / ganglions / métastases, stades I à IV), qui décrit la croissance tumorale dans la paroi du rectum ou du côlon (stade II), l’atteinte des ganglions lymphatiques régionaux (stade III) et la propagation métastatique à d'autres organes (stade IV). Une méta-analyse récente a identifié l'existence d'au moins 4 sous-types consensus moléculaires (CMS) distincts basés sur des profils d'expression génique spécifiques : le sous-type immunitaire (CMS1), canonique (CMS2), métabolique (CMS3) et mésenchymateux (CMS4). Il est important de noter que les différents CMS répondent différemment aux traitements actuellement disponibles, ainsi seuls les patients de type CMS2 répondent bien aux thérapies conventionnelles.
La cycline A2 est un régulateur connu de la prolifération cellulaire et est souvent utilisée comme marqueur de prolifération. Peu d'études ont, à ce jour, exploré le rôle de la cycline A2 dans le développement tumoral in vivo à l’aide de modèles murins génétiquement modifiés.
Pour clarifier la fonction de la cycline A2 dans l'homéostasie du côlon et le cancer colorectal (CCR), les chercheurs ont généré des souris déficientes en cycline A2 dans les cellules épithéliales du côlon (CEC). Le côlon de ces souris présente des modifications architecturales de la muqueuse et des signes d'inflammation ainsi qu'une prolifération accrue des CEC associée à l'apparition de dysplasies (anomalies cellulaires) de bas et de haut grade. Les principaux événements déclencheurs de ces altérations correspondent à l’apparition de mitoses anormales et de dommages à l'ADN. De plus, les chercheurs ont détecté une activité accrue de la voie WNT canonique, une voie hautement conservée au cours de l'évolution, régule les fonctions cellulaires clés, notamment la prolifération, la différenciation, la migration, la stabilité génétique, l'apoptose et le renouvellement des cellules souches et connue pour être dérégulée dans divers cancers, notamment le CCR. La suppression de la cycline A2 dans les CEC favorise aussi le développement de dysplasies et d'adénocarcinomes dans le modèle murin de cancer associé à la colite. Les scientifiques ont également exploré le statut d’expression de la cycline A2 dans des échantillons cliniques de CCR au niveau des ARN messager et des protéines, et ont trouvé une expression plus élevée dans les tumeurs des patients de stade I et II par rapport à celles de stade III et IV. Une méta-analyse de 11 bases de données transcriptomiques comprenant 2239 tumeurs CCR primaires a révélé différents niveaux d'expression de CCNA2 (l'ARNm codant pour la cyclineA2), le sous-type CMS1 présentant l’expression la plus élevée alors que le sous-type CMS4, associé à un mauvais pronostic, exprime le taux le plus bas. De plus, une expression élevée de CCNA2 s'avère être un nouveau facteur de pronostic indépendant pour les tumeurs CCR.
En conclusion, l'expression de la cycline A2 dans les tissus du CCR reflète des rôles distincts au cours de la carcinogenèse du côlon, tels que l’induction d’une prolifération cellulaire aux stades précoces, lorsqu'elle est fortement exprimée, mais favorisant l'agressivité aux stades suivants, lorsque les niveaux d'expression sont plus faibles. Par conséquent, cette analyse sur la cycline A2 illustre de manière frappante la complexité du CCR, c'est-à-dire qu'une protéine peut exécuter des fonctions distinctes aux différentes étapes du développement de la tumeur, ce qui complique la mise en place de stratégies thérapeutiques.
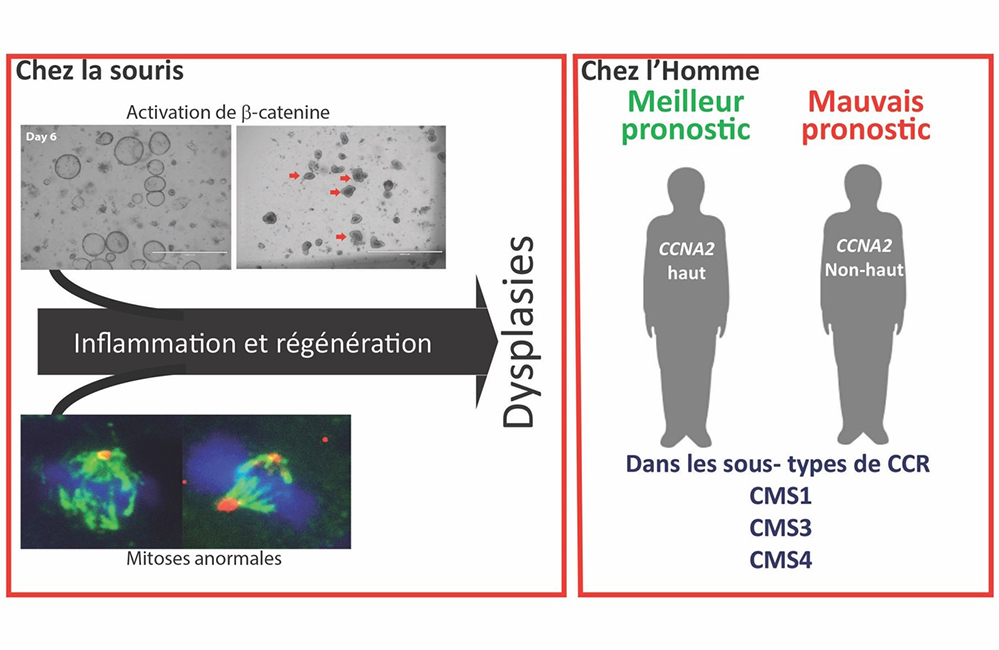
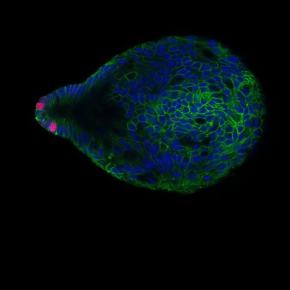
Figure : Chez la souris, l’inactivation de la Cycline A2 dans les cellules épithéliales de colon conduit à des mitoses anormales (images du bas représentant les fuseaux mitotiques en vert, l’ADN en bleu et les centrosomes en rouge), et une activation accrue de la beta-caténine, le médiateur de la voie Wnt, montrée ici grâce à une culture in vitro d’organoïdes coliques déficients (image du haut): les organoïdes mutants cultivés en milieu conventionnel forment des cystes,caractéristique d’une activation de la voie Wnt et sont seulement capables de se différencier en absence de promoteur de la voie Wnt, Wnt3a (à droite ; «budding» ou différenciation; indiqué par des flèches rouges. Barre d'échelle : 1 nm). Ces événements induisent une inflammation et l’activation de voies régénératives qui conduisent à la formation de dysplasies. Chez l’Homme, les tumeurs de CCR exprimant fortement la cycline A2 sont de meilleur pronostic que celles l’exprimant moins fortement, spécialement pour les sous-types CMS1, 3 et 4 du CCR, pour lesquels peu d’options thérapeutiques existent.
Pour en savoir plus :
Cyclin A2 maintains colon homeostasis and is a prognostic factor in CRC.
Guo Y, Gabola M, Lattanzio R, Paul C, Pinet V, Tang R, Turali H, Bremond J, Longobardi C, Maurizy C, Da Costa Q, Finetti P, Boissière-Michot F, Rivière B, Lemmers C, Garnier S, Bertucci F, Zlobec I, Chebli K, Tazi J, Azar R, Blanchard JM, Sicinski P, Mamessier E, Lemmers B, Hahne M.
J Clin Invest. 2020 Dec 17:131517. doi: 10.1172/JCI131517.
Contact
Laboratoire
Institut de génétique moléculaire de Montpellier (IGMM) - (CNRS/Université de Montpellier)
1919 route de Mende, 34293 Montpellier
Cancer research center of Marseille (CRCM) - (Inserm/CNRS/ Université Aix-Marseille)
27 Boulevard Leï Roure - CS 30059
13273 Marseille Cedex 09