Une communication électrique entre les cellules β du pancréas coordonne la sécrétion d’insuline
Après un repas, la partie endocrine du pancréas sécrète de l’insuline en deux phases, au cours desquelles des cellules, appelées cellules β, se coordonnent pour une sécrétion optimale. Des chercheurs du CBMN (CNRS/Université de Bordeaux/Bordeaux INP), de l’IMS (CNRS/Université de Bordeaux/Bordeaux INP), de l’INCIA (CNRS/Université de Bordeaux) et de l’université de Genève (Suisse) ont en effet découvert que ces cellules se synchronisent grâce à des signaux électriques, et que ce système fonctionne mal en conditions diabétogènes. Publiés dans le journal Diabetes, ces travaux aident à mieux comprendre la sécrétion d’insuline et serviront de référence pour la génération de substituts aux cellules β à partir de cellules souches.
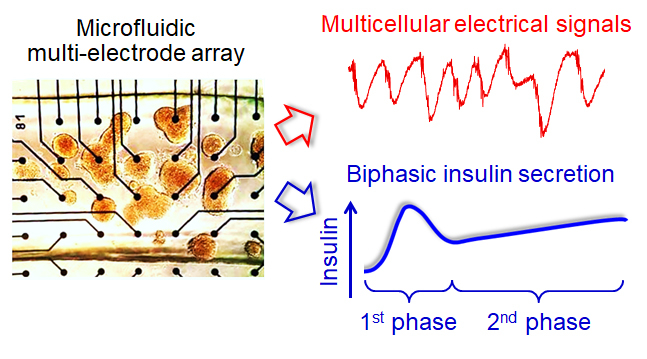
Comme de nombreuses hormones, l’insuline est sécrétée par notre corps en deux phases. Elle est d’abord libérée via une dose de charge, forte et immédiate, avant de passer à une dose de maintien, plus modérée. La glycémie est ainsi réduite et finement contrôlée après un repas par cette sécrétion biphasique d’insuline. L’insuline est libérée par les cellules β des îlots de Langerhans, qui sont des groupes de cellules organisées en microorganes au sein du pancréas. Alors que cette sécrétion biphasique est fortement perturbée dans des pathologies telles que le diabète de type 2, le détail de son fonctionnement restait encore mal connu. Des chercheurs de l’Institut de chimie et de biologie des membranes et des nanoobjets (CBMN, CNRS/Université de Bordeaux/Bordeaux INP), du laboratoire d’Intégration du matériau au système (IMS, CNRS/Université de Bordeaux/Bordeaux INP), de l’Institut de neurosciences cognitives et intégratives d’Aquitaine (INCIA, CNRS/Université de Bordeaux) et de l’Université de Genève (Suisse) ont démontré que la sécrétion biphasique d’insuline était contrôlée par des signaux électriques entre les cellules β, qui parviennent à se synchroniser pour une sécrétion d’hormones finement régulée pour plus d’efficacité.
Les auteurs ont pour cela développé un système microfluidique qui récupère l’insuline sécrétée par les cellules et mesure en parallèle, grâce à de nombreuses microélectrodes, leurs signaux électriques au rythme de dix mille mesures par seconde. Cette cadence permet d’étudier avec une grande finesse les évènements cellulaires et multicellulaires impliqués dans la sécrétion biphasique. En première phase, les cellules sont peu synchronisées, mais très actives, pour faire rapidement baisser la glycémie. Cet état est transitoire, car il “épuise” les cellules. En seconde phase, elles se synchronisent au travers de leur activité électrique, comme le fait un réseau de neurones, pour atteindre un rythme plus “économique” jusqu’à la fin de la digestion. L’équipe a également constaté que ces deux phases électriques étaient fortement altérées au cours du vieillissement, ainsi que dans des conditions diabétiques. Les auteurs vont à présent rechercher si les autres cellules des îlots pancréatiques influencent la sécrétion biphasique par les cellules β. Ils vont également étudier les cellules souches capables de devenir des cellules β, dont l’activité électrique et les signaux synchronisateurs n’ont pas encore été explorés. Ces travaux pourraient permettre, à plus long terme, d’aboutir à des thérapies cellulaires efficaces contre certaines formes de diabète.
Ces travaux de recherche sont soutenus financièrement par le programme H2020 (convention n° 840395)."
Référence
Dynamic uni- and multicellular patterns encode biphasic activity in pancreatic islets Jaffredo M, Bertin E, Pirog A, Puginier E, Gaitan J, Oucherif S, Lebreton F, Bosco D, Catargi B, Cattaert D, Renaud S, Lang J et Raoux M, Diabetes, 2021. 70(4):878-888.
Doi: 10.2337/db20-0214
