Nétrine-1 : de celle qui guide à celle qui attache
La nétrine-1 est une molécule qui participe au guidage des axones pendant le développement du système nerveux. Depuis sa découverte en 1994, il est admis que la nétrine-1 est sécrétée au niveau d’une structure médiane, la plaque du plancher, et que sa diffusion établit un gradient attirant certains axones ventralement. Ce dogme vient d’être remis en cause par les équipes de Patrick Mehlen au Centre de recherche en cancérologie de Lyon, et d’Alain Chédotal à l'Institut de la vision qui démontrent que le guidage de ces axones est normal en l’absence de la nétrine-1 à la plaque du plancher. Cette étude qui suggère un rôle de la nétrine-1 dans l’adhérence des neurones dans des domaines précis du cerveau embryonnaire a été publiée le 18 mai 2017 dans la revue Nature.
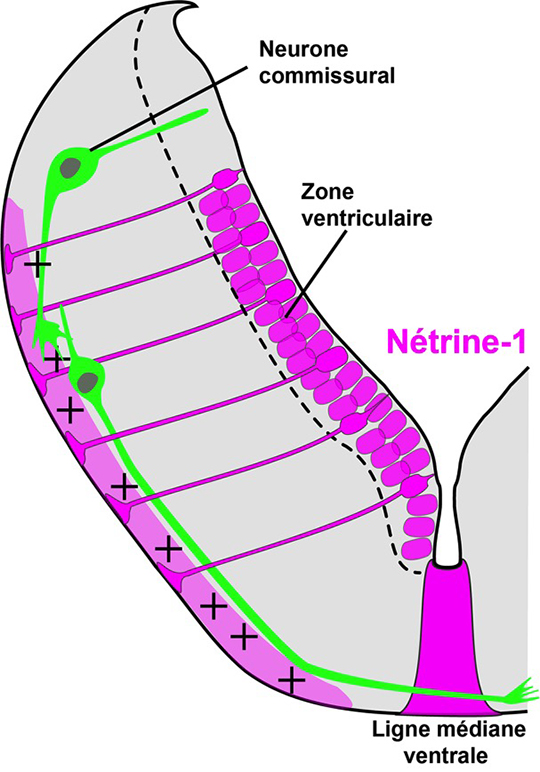
Le cerveau de la plupart des espèces animales contient des neurones, appelés commissuraux, dont l’axone est connecté à des neurones cibles situés du côté opposé. C’est pendant le développement embryonnaire que les axones commissuraux traversent la ligne médiane du système nerveux. Ramón y Cajal, le célèbre neurobiologiste de la fin du XIXème siècle, avait postulé que la croissance en direction ventrale des axones commissuraux depuis la région dorsale du cerveau était orientée par des signaux attractifs à longue distance diffusant depuis des cellules de la ligne médiane ventrale (appelée plaque du plancher).
La quête de ces molécules dites chimio-attractives, véritable Graal pour les neurobiologistes, prit près d’un siècle, et ce n’est qu’en 1994 que Marc Tessier-Lavigne et son équipe réussirent à purifier une protéine sécrétée exprimée à la plaque du plancher, qui fut nommé nétrine-1, « celui qui guide » en Sanskrit 1 . Les travaux ultérieurs utilisant des cultures de neurones commissuraux, puis des animaux génétiquement mutants pour nétrine-1, ont conduit à proposer un modèle, présent dans tous les manuels de biologie, selon lequel un gradient ventro-dorsal de nétrine-1 produit par la plaque du plancher permet, en se liant à un récepteur appelé DCC, l’attraction des axones commissuraux 2 3 4 . Ce modèle très séduisant a d’ailleurs contribué à lancer une intense vague de recherche des mécanismes du guidage axonal qui a conduit à l’identification de plusieurs nouvelles familles de molécules telles que les sémaphorines, les éphrines et les Slits.
Toutefois, quelques failles sont apparues dans cet élégant modèle : premièrement, à l’exception d’un article publié par Kennedy et collaborateurs en 2005 5 , aucun travail n’a en 25 ans de recherche réussi à montrer la présence d’un gradient de nétrine-1; deuxièmement, la nature collante, adhésive de nétrine-1, qui appartient à la famille des laminines, apparaissait difficilement conciliable avec sa présence en solution dans un gradient de diffusion, à l’instar des morphogènes de type Sonic Hedgehog. Certaines études réalisées chez la mouche drosophile, avaient commencé à fragiliser encore plus ce modèle. Tout d’abord, Brankatschk et Dickson ont montré qu’une nétrine-1 génétiquement modifiée et ancrée à la membrane plasmique restait fonctionnelle dans un modèle de guidage axonal 6 . Plus récemment, Akin et Zipursky ont proposé que la nétrine-1 permet l’ancrage des axones visuels à un substrat et n’agit pas à distance 7 .
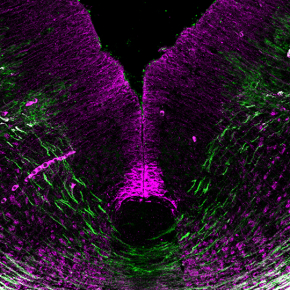
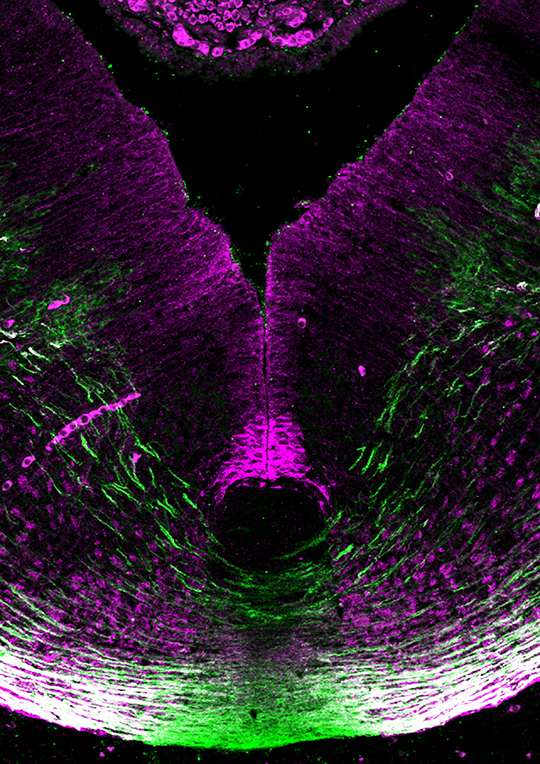
Deux études viennent de remettre en cause le modèle chez les mammifères. Les équipes d’Alain Chédotal et de Patrick Mehlen (voir référence ci-dessous: En savoir plus), et de manière indépendante celle de Samantha Butler 8 , ont réussi à modifier génétiquement des souris pour empêcher la production de nétrine-1 par la plaque du plancher, l’unique source supposée de ce facteur. A leur surprise, les chercheurs ont constaté que les axones commissuraux se développent normalement, croissent ventralement et traversent la plaque du plancher. Ils ont découvert que la nétrine-1 est également produite dorsalement par des précurseurs de neurones qui la libèrent à la surface du cerveau. L’ablation génétique de cette source dorsale de nétrine-1 empêche les axones de pousser ventralement. Le nouveau modèle suggère que la nétrine-1 participe localement au guidage des axones commissuraux en agissant comme une molécule d’adhésion assurant l’ancrage des axones commissuraux dans des domaines bien précis du cerveau embryonnaire. Ces travaux remettent donc en question le modèle classiquement admis de gradient de diffusion à longue distance de molécules de guidage axonal. Il conduit aussi à s’interroger sur la véritable fonction et le mécanisme d’action de la nétrine-1 qui a depuis été impliquée dans de nombreuses pathologies telle que le cancer, le diabète ou l’arthrite inflammatoire.
© Juan Antonio Moreno Bravo et Alain Chédotal. Institut de la Vision.
© Alain Chédotal. Institut de la Vision
En savoir plus
-
Floor-plate-derived netrin-1 is dispensable for commissural axon guidance.
Dominici C, Moreno-Bravo JA, Puiggros SR, Rappeneau Q, Rama N, Vieugue P, Bernet A, Mehlen P, Chédotal A.
Nature. 2017 Apr 26. doi: 10.1038/nature22331.
- 1Serafini, T. et al. Cell 78, 409–424 (1994).
- 2kennedy, T. E et al. Cell 78, 425–435 (1994)
- 3Serafini, T. et al. Cell 87, 1001–1014 (1996).
- 4Fazeli, A. et al. Nature 386, 796–804 (1997).
- 5Kennedy, T. E. et al. J. Neurosci. 26, 8866–8874 (2006).
- 6Brankatschk, M. & Dickson, B. J. Nat. Neurosci. 9, 188–194 (2006).
- 7Akin, O. & Zipursky, S. L. eLife 5, e20762 (2016).
- 8Varadarajan SG, et al. Neuron. 2017 Apr 20. pii: S0896-6273(17)30190-3. doi: 10.1016/j.neuron.2017.03.007