Lutter contre l'acidité pour survivre: le bacille tuberculeux n'avait pas dit son dernier mot
La lutte contre les bactéries infectieuses nécessite la compréhension au niveau moléculaire des stratégies de défense, souvent très élaborées, qu'elles déploient pour désamorcer les défenses de l'hôte. Les équipes de Priscille Brodin au Centre d'infection et d'immunité de Lille et de Roland Brosch à l’Institut Pasteur, en collaboration avec Edouard Yeramian, montrent que pour lutter contre la défense acide, Mycobacterium tuberculosis peut détourner à son profit une voie cellulaire de l'hôte, afin d'induire l'expression d’une protéine conduisant à la dégradation de la pompe à protons. Cette étude a été publiée le 26 septembre 2017 dans la revue Cell Reports.
Depuis les travaux précurseurs de Metchnikoff, une attention particulière a été portée aux mécanismes spécifiques permettant aux bactéries de lutter contre l'acidité rencontrée dans les phagosomes qui sont des vésicules intracellulaires contenant les bactéries qui ont été ingérées par les macrophages.
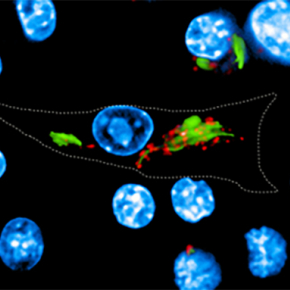
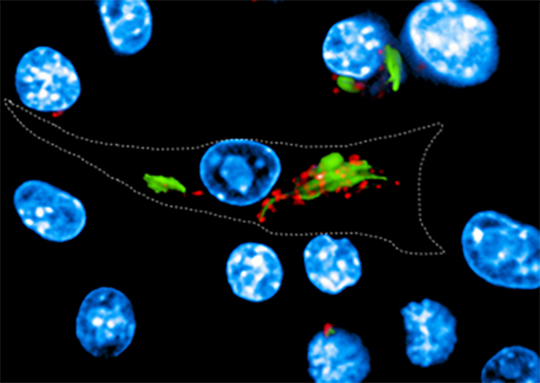
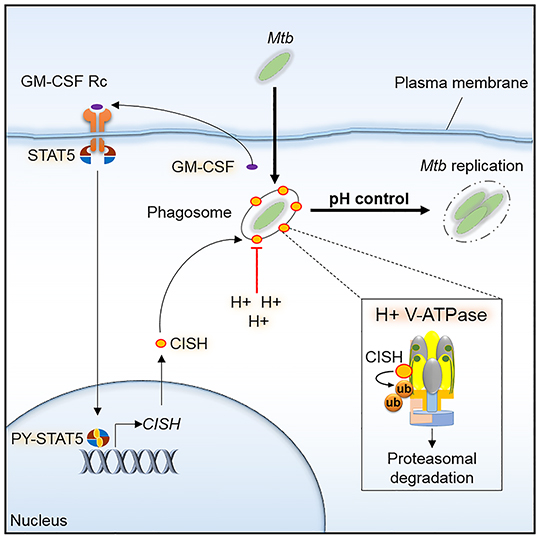
Dans le cas de Mycobacterium tuberculosis, responsable de la tuberculose, cette défense était attribuée à un facteur de virulence secrété par la bactérie, agissant au niveau des pompes à protons (V-ATPase) à la surface des phagosomes et permettant précisément de créer un milieu intérieur acide hostile. Des recherches menées par l'équipe de Priscille Brodin (Institut Pasteur de Lille et de Corée) en collaboration avec Edouard Yeramian et l’équipe de Roland Brosch à l'Institut Pasteur de Paris, et Akihiko Yoshimura à l'Université Keio à Tokyo, révèlent que pour lutter contre la défense acide M. tuberculosis a "plus d'un tour dans ses manches". De fait il apparaît que M. tuberculosis peut détourner à son profit une voie cellulaire de l'hôte, afin d'induire l'expression de la protéine CISH (membre de la famille de protéines SOCS, impliquées dans les régulations immunitaires), s'attachant alors à une sous-unité spécifique de la pompe à protons et conduisant à sa dégradation.
Au-delà même des possibilités thérapeutiques potentielles, cette découverte ouvre des perspectives dans différentes directions. Une synergie fonctionnelle peut être envisagée entre le nouveau modèle et le modèle antérieur. Par ailleurs les mécanismes de défense mis en évidence pour le bacille tuberculeux, ou des déclinaisons de ces mécanismes, pourraient intervenir dans d'autres pathologies infectieuses, causées par des bactéries ou même des parasites. Il est d'ailleurs intéressant de noter que des corrélations ont été observées au cours de plusieurs études entre des susceptibilités accrues à différentes maladies infectieuses et des polymorphismes génétiques de CISH. Des études plus approfondies devraient permettre de déterminer dans quelle mesure ces corrélations peuvent se rapporter au nouveau modèle.
© Queval CJ et al. Cell Rep. 2017. 13:3188-3198. CC-BY-NC-ND4.0
© Queval CJ et al. Cell Rep. 2017. 13:3188-3198. CC-BY-NC-ND4.0
En savoir plus
-
Mycobacterium tuberculosis Controls Phagosomal Acidification by Targeting CISH-Mediated Signaling.
Queval CJ, Song OR, Carralot JP, Saliou JM, Bongiovanni A, Deloison G, Deboosère N, Jouny S, Iantomasi R, Delorme V, Debrie AS, Park SJ, Gouveia JC, Tomavo S, Brosch R, Yoshimura A, Yeramian E, Brodin P.
Cell Rep. 2017 Sep 26;20(13):3188-3198. doi: 10.1016/j.celrep.2017.08.101