Le mécanisme moléculaire responsable du développement de la maladie de Charcot dévoilé
Des chercheurs du laboratoire Architecture et réactivité de l’ARN, en collaboration avec des chercheurs de l’université Harvard (USA), ont élucidé les mécanismes moléculaires qui gouvernent la synthèse aberrante de longues chaines de polydipeptides dans les cerveaux de patients atteints de Sclérose Latérale Amyotrophique ou maladie de Charcot. Ces résultats ont été publiés le 11 janvier 2018 dans la revue Nature Communications.
La maladie de Charcot, également appelée Sclérose Latérale Amyotrophique (SLA), a récemment été mise sur le devant de la scène médiatique française par le décès au cours de l’été 2017 de l’ex-tennisman professionnel Jérôme Golmard. Cette pathologie, généralement fatale et incurable, est caractérisée par la neuro-dégénérescence des motoneurones entrainant une paralysie progressive des muscles. Le désormais célèbre « Ice Bucket Challenge » (défi du seau d’eau glacée), dont la pratique a été largement relayée par les réseaux sociaux, a permis de récolter des fonds dédiés à la recherche sur la SLA. Grâce à ce défi, d’importants moyens financiers ont été mis à la disposition des chercheurs pour leurs travaux sur cette pathologie. Cependant, malgré de nombreuses études, les mécanismes moléculaires mis en jeu au cours du développement de cette maladie demeuraient inconnus.
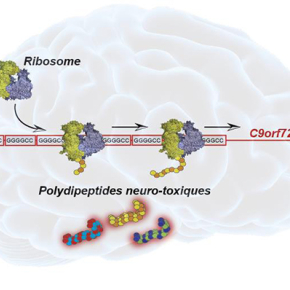
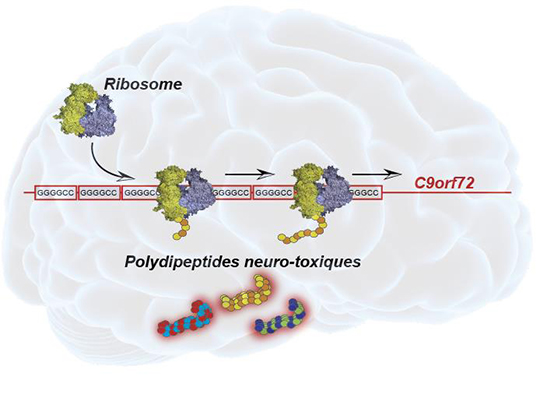
Les chercheurs ont percé ce mystère en décortiquant pour la première fois le mécanisme moléculaire responsable du développement de la maladie de Charcot. Dans toute cellule, les protéines sont synthétisées par une machinerie macromoléculaire complexe appelée ribosome. Les chercheurs ont montré que des séquences, répétées anormalement un grand nombre de fois dans le gène C9orf72 chez les patients, attirent de manière aberrante le ribosome qui se met alors à traduire ces séquences répétitives en polydipeptides. Ces études ont permis en particulier de localiser précisément le site de démarrage de la traduction et également de démontrer qu’un décalage du cadre de lecture (« frameshift ») est nécessaire au cours de la synthèse des polydipeptides par le ribosome.
Ces polydipeptides sont hautement toxiques pour la cellule parce que leur accumulation dans les motoneurones entraine leur agrégation qui provoque la mort cellulaire. Ces travaux permettent de mieux comprendre les mécanismes moléculaires qui aboutissent à la synthèse et l’accumulation de ces polydipeptides dans les motoneurones des patients. Ils ouvrent de nouvelles perspectives de traitements thérapeutiques visant à bloquer cette synthèse protéique aberrante.
Il est important de noter que d’autres maladies neuro-dégénératives (Ataxie, Maladie de Huntington, syndrome du l’X fragile etc …), également liées à l’apparition de séquences répétées, semblent suivre les mêmes règles moléculaires. De ce fait, cette découverte constitue une étape majeure pour l’amélioration de la santé humaine dans la lutte contre ces maladies.
© Franck Martin
En savoir plus
-
Ricardos Tabet, Laure Schaeffer, Fernande Freyermuth, Melanie Jambeau, Michael Workman, Chao-Zong Lee, Chun-Chia Lin, Jie Jiang, Karen Jansen-West, Hussein Abou-Hamdan, Laurent Désaubry, Tania Gendron, Leonard Petrucelli, Franck Martin, Clotilde Lagier-Tourenne. Nature Communications. 9, Article number: 152(2018). doi:10.1038/s41467-017-02643-5. Published online:11 January 2018