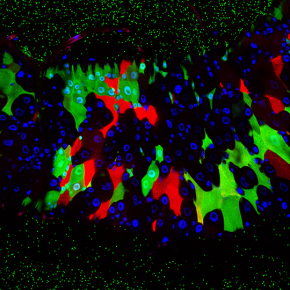
La drosophile à l’épreuve du microbiote intestinal
Notre tube digestif abrite une population extrêmement complexe de virus, bactéries et autres champignons, appelée microbiote. Si l’immense majorité de ces microorganismes vit en bonne intelligence avec nous, l’équilibre est fragile et son dérèglement peut avoir de graves conséquences pour notre santé. L’étude des interactions microbiote-hôte est plus aisée chez la drosophile dont le tube digestif ne comporte qu’une dizaine d’espèces bactériennes contre plusieurs centaines chez nous. Cette étude publiée le 14 Février 2018 dans la revue Cell Host Microbe (dont elle illustre la page de couverture) montre comment la drosophile contrôle les bactéries de son microbiote afin d’éviter qu’elles n’affectent son intégrité.
Notre tube digestif abrite un microbiote intestinal fait de bactéries, virus et autres champignons non pathogènes. Un dialogue permanent existe entre les bactéries du microbiote et les tissus et organes de l'hôte qui contribue au développement normal du tube digestif et de son système immunitaire. Le microbiote assure également un rôle endocrinien en produisant des métabolites qui après avoir franchi la paroi intestinale peuvent moduler la fonction d’organes situés à distance de l’intestin. Des aberrations dans la population microbienne intestinale, appelées dysbioses, provoquent non seulement des pathologies locales comme les maladies inflammatoires de l'intestin, mais affectent bien plus largement leurs hôtes allant jusqu'à influencer leur comportement en agissant sur le système nerveux.
L'équipe de Julien Royet, à l’Institut de Biologie du Développement de Marseille, étudie les dialogues moléculaires entre le microbiote et l’hôte chez la drosophile. Des travaux précédents de l’équipe avaient mis en évidence la sécrétion d’un peptidoglycane par les bactéries intestinales qui active le système immunitaire de l’hôte et qui est aussi capable diffuser dans l’organisme pour modifier l’activité de neurones dans le système nerveux. Dans cette nouvelle étude, l’équipe démontre comment la drosophile développe un système de défense qui utilise deux versions d’une même enzyme de digestion du peptidoglycane pour contrôler simultanément son immunogénicité et sa diffusion dans l’organisme. En l’absence de cette enzyme, les drosophiles présentent des signes de dégénérescence tissulaire liés à l’invasion du peptidoglycane dans l’organisme et ont une durée de vie plus courte.
Ces travaux chez la drosophile ouvrent de nouvelles perspectives pour comprendre les rôles du peptidoglycane du microbiote intestinal des mammifères. Dans ce sens, des résultats récemment publiés par une équipe suédoise suggèrent que le peptidoglycane pourrait également servir de métabolite circulant et moduler la physiologie et le comportement des souris.
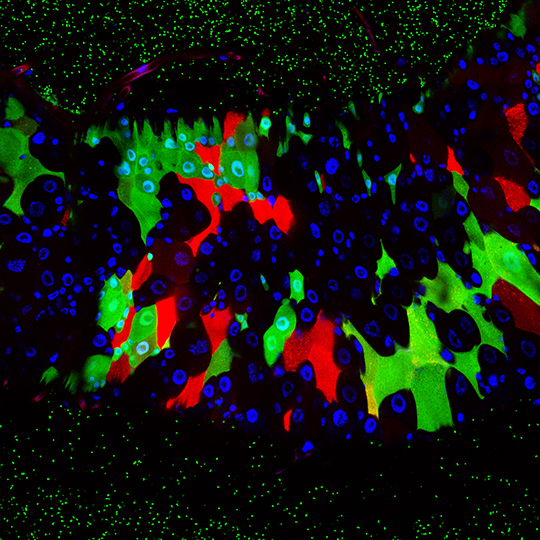
© Bernard Charroux
En savoir plus
-
Cytosolic and Secreted Peptidoglycan-Degrading Enzymes in Drosophila Respectively Control Local and Systemic Immune Responses to Microbiota. Charroux B, Capo F, Kurz CL, Peslier S, Chaduli D, Viallat-Lieutaud A, Royet J. Cell Host Microbe. 2018 Jan 30. pii: S1931-3128(17)30543-7. doi: 10.1016/j.chom.2017.12.007. [Epub ahead of print]