Inhibiteurs de la protéine NS5A du virus de l’hépatite C : une seule cible pour deux actions antivirales
L’équipe de François-Loïc Cosset au Centre international de recherche en infectiologie, a élucidé un des modes d’action du Daclatasvir, un inhibiteur de la protéine NS5A requise pour la réplication du génome viral et l’assemblage du virus VHC. Cette étude qui ouvre la voie au développement d’inhibiteurs de nouvelle génération, a été publiée le 5 décembre 2016 dans la revue Gastroenterology.
Environ 180 millions de personnes sont infectées par le virus de l’hépatite C (VHC) à travers le monde. L’infection chronique engendre des perturbations hépatiques qui peuvent évoluer en cirrhose ou en hépato-carcinome. La compréhension moléculaire détaillée de certaines étapes clefs du cycle viral a permis le développement d’antiviraux à action directe à un rythme très soutenu depuis le début des années 2010, autorisant pour la première fois un réel espoir de guérison pour les personnes infectées. Ces inhibiteurs extrêmement efficaces ciblent spécifiquement 3 protéines virales agissant à des étapes différentes du cycle infectieux. On distingue les inhibiteurs de la protéase NS3/4A qui interfèrent avec le clivage de la polyprotéine virale, les inhibiteurs de la polymérase NS5B qui bloquent la réplication du génome viral, et les inhibiteurs de la phospho-protéine NS5A qui impactent la réplication et l’assemblage du virus. Si les mécanismes d’action des deux premières classes d’inhibiteurs sont relativement bien connus, celui des inhibiteurs de NS5A reste mal défini.
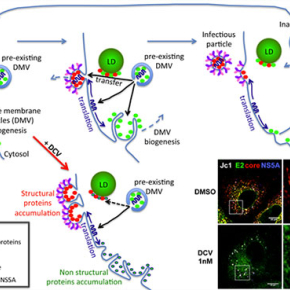
En utilisant des techniques d’imagerie pointues, l’équipe « Virus Enveloppés, Vecteurs et Immunothérapie », de François-Loïc Cosset a permis de conforter le rôle d’un inhibiteur de la protéine NS5A dans l’assemblage du VHC et de caractériser son mode d’action. Les chercheurs ont montré que le Daclatasvir (DCV), utilisé en clinique, induit très rapidement une agrégation de NS5A (protéine non-structurale impliquée dans la formation des structures de réplication et dans l’assemblage viral), mais également l’agrégation des protéines structurales core (protéine de capside) et E2 (glycoprotéine d’enveloppe) ainsi que de la protéine non-structurale NS4B (protéine impliquée dans la formation des structures de réplication) au sein de mêmes sites intracellulaires. Ces travaux ont également permis de mettre en évidence l’existence de telles structures au cours de l’établissement de l’infection, en absence de DCV, indiquant que les sites de réplication et d’assemblage du virus sont intimement associés et que l’inhibition de l’assemblage induit leur agrégation en concentrant les protéines non mobilisées pour la production de particules virales. Plus spécifiquement, ces travaux ont enfin démontré que le DCV bloque le transfert du génome viral (un ARN simple brin positif), lequel est effectué par la protéine NS5A depuis les sites de réplication jusqu’aux sites d’assemblage des particules virales.
Ce mécanisme d’inhibition de l’assemblage viral s’ajoute donc à celui précédemment mis en évidence de l’inhibition de la réplication du génome. Ainsi, le DCV, en ciblant une seule protéine, NS5A, agit de concert sur l’inhibition de deux étapes clefs du cycle viral. Quelques heures seulement après l’initiation du traitement, le DCV bloque le transfert du génome viral vers les sites d’assemblage, stoppant ainsi très rapidement la production de nouvelles particules virales. Parallèlement, la drogue bloque la formation de nouvelles structures de réplication, en continuel renouvellement, agissant donc plus tardivement sur la production de nouvelles molécules d’ARN viral.
La compréhension du mécanisme d’action à deux niveaux de cette classe d’inhibiteurs de la protéine NS5A pourrait ainsi expliquer l’extrême efficacité de ces molécules sur les cellules infectées et devrait faciliter le développement d’inhibiteurs de prochaine génération pour contrer les mutations de résistances qui apparaissent chez certains patients.
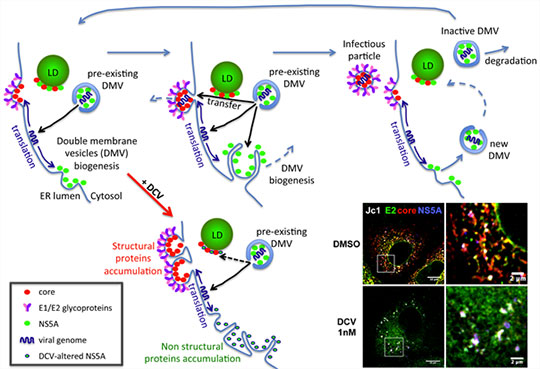
© Bertrand Boson et François-Loïc Cosset
En savoir plus
-
Daclatasvir Prevents Hepatitis C Virus by Blocking Transfer of Viral Genome to Assembly Sites
Bertrand Boson, Solène Denolly, Fanny Turlure, Christophe Chamot, Marlène Dreux, François-Loïc Cosset
Gastroenterology. online: December 5, 2016.
DOI:http://dx.doi.org/10.1053/j.gastro.2016.11.047